Как рассчитать оплату за отопление по своей квартире?
Вопрос о расчете размера платы за отопление является очень важным, так как суммы по данной коммунальной услуге потребители получают зачастую довольно внушительные, в то же время не имея никакого понятия, каким образом производился расчет.
С 2012 года, когда вступило в силу Постановление Правительства РФ от 06 мая 2011 №354 «О предоставлении коммунальных услуг собственникам и пользователям помещений в многоквартирных домах и жилых домов» порядок расчета размера платы за отопление претерпел ряд изменений.
Несколько раз менялись методики расчета, появлялось отопление, предоставленное на общедомовые нужды, которое рассчитывалось отдельно от отопления, предоставленного в жилых помещениях (квартирах) и нежилых помещениях, но затем, в 2013 году отопление вновь стали рассчитывать как единую коммунальную услугу без разделения платы.
Расчет размера платы за отопление менялся с 2017 года, и в 2019 году порядок расчета вновь изменился, появились новые формулы расчета размера платы за отопление, в которых разобраться обычному потребителю не так уж и просто.
Для того чтобы рассчитать размер платы за отопление по своей квартире и выбрать нужную формулу расчета необходимо, в первую очередь знать:
1. Имеется ли на Вашем доме централизованная система теплоснабжения?
Это означает поступает ли тепловая энергия на нужды отопления в Ваш многоквартирный дом уже в готовом виде с использованием централизованных систем или тепловая энергия для Вашего дома производится самостоятельно с использованием оборудования, входящего в состав общего имущества собственников помещений в многоквартирном доме.
2. Оборудован ли Ваш многоквартирный дом общедомовым (коллективным) прибором учета, и имеются ли индивидуальные приборы учета тепловой энергии в жилых и нежилых помещениях Вашего дома?
Наличие или отсутствие общедомового (коллективного) прибора учета на доме и индивидуальных приборов учета в помещениях Вашего дома существенно влияет на способ расчета размера платы за отопление.
3. Каким способом Вам производится начисление платы за отопление – в течение отопительного периода либо равномерно в течение календарного года?
Каким способом Вам производится начисление платы за отопление – в течение отопительного периода либо равномерно в течение календарного года?
Способ оплаты за коммунальную услугу по отоплению принимается органами государственной власти субъектов Российской Федерации. То есть, в различных регионах нашей страны плата за отопление может начисляться по разному — в течение всего года или только в отопительный период, когда услуга фактически предоставляется.
4. Имеются ли в Вашем доме помещения, в которых отсутствуют приборы отопления (радиаторы, батареи), или которые имеют собственные источники тепловой энергии?
Именно с 2019 года в связи с судебными решениями, процессы по которым проходили в 2018 году, в расчете стали участвовать помещения, в которых отсутствуют приборы отопления (радиаторы, батареи), что предусмотрено технической документацией на дом, или жилые и нежилые помещения, переустройство которых, предусматривающее установку индивидуальных источников тепловой энергии, осуществлено в соответствии с требованиями к переустройству, установленными действующим на момент проведения такого переустройства законодательством Российской Федерации.
Для того чтобы информация по расчету размера платы за отопление была более понятна, мы рассмотрим каждый способ начисления платы отдельно, с применением той или иной формулы расчета на конкретном примере.
При выборе варианта расчета необходимо обращать внимание на все составляющие, которые определяют методику расчета.
Ниже представлены различные варианты расчета с учетом отдельных факторов, которые и определяют выбор расчета размера платы за отопление:
Расчет №1 Размер платы за отопление в жилом/нежилом помещении, ОДПУ на многоквартирном доме отсутствует, расчет размера платы осуществляется в течение отопительного периода. Ознакомиться с порядком и примером расчета →
Расчет №2 Размер платы за отопление в жилом/нежилом помещении, ОДПУ на многоквартирном доме отсутствует, расчет размера платы осуществляется в течение календарного года (12 месяцев).
Расчет №3 Размер платы за отопление в жилом/нежилом помещении, на многоквартирном доме установлен ОДПУ, индивидуальные приборы учета во всех жилых/нежилых помещениях отсутствуют, плата за отопление производится в течение отопительного периода. Ознакомиться с порядком и примером расчета →
Расчет №3-1 Размер платы за отопление в жилом/нежилом помещении, на многоквартирном доме установлен ОДПУ, индивидуальные приборы учета во всех жилых/нежилых помещениях отсутствуют, плата за отопление производится равномерно в течение календарного года
Расчет №4 Размер платы за отопление в жилом/нежилом помещении, на многоквартирном доме установлен ОДПУ, индивидуальные приборы учета установлены не во всех помещениях многоквартирного дома, плата за отопление производится в течение отопительного периода.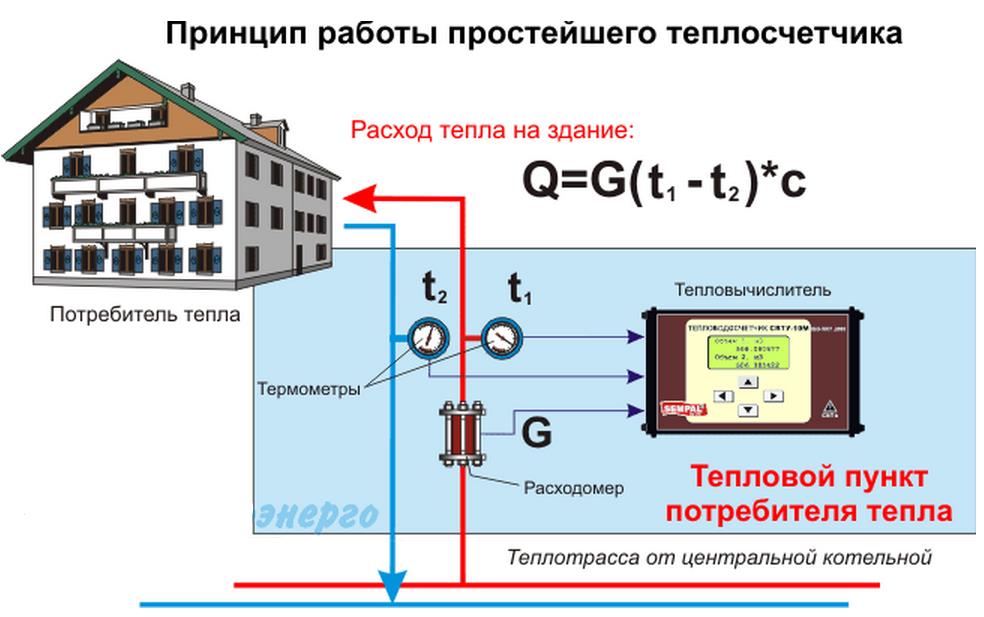 Ознакомиться с порядком и примером расчета →
Ознакомиться с порядком и примером расчета →
Расчет №4-1Размер платы за отопление в жилом/нежилом помещении, на многоквартирном доме установлен ОДПУ, индивидуальные приборы учета установлены не во всех помещениях многоквартирного дома
Расчет №5 Размер платы за отопление в жилом/нежилом помещении, на многоквартирном доме установлен ОДПУ, индивидуальные приборы учета установлены всех жилых/нежилых помещениях многоквартирного дома. Ознакомиться с порядком и примером расчета →
Читайте также:
Расчёт затрат на тепловую и электрическую энергию
Расчёт затрат на тепловую и электрическую энергиюРасчёт затрат на тепловую и электрическую энергию
На источниках и насосных станциях при выполнении поверочного расчёта определяются часовые
затраты на тепловую, электрическую энергию и затраты на тепловые потери в трубопроводах.
Это позволяет при моделировании различных ситуаций сравнить экономические затраты на эксплуатацию.
Затраты на электроэнергию
Затраты на электроэнергию рассчитываются как произведение полезной мощности насоса (P) и стоимости электроэнергии, определяются по формуле:
Рисунок 158. Затраты на электроэнергию
, где G — расход воды, т/ч.
g — ускорение свободного падения, м/с2.
H — напор развиваемый насосом (или располагаемый напор на источнике), м.
Costэ — стоимость электроэнергии за 1 кВт
(значение поля базы данных Затраты на электроэнергию , Costs_w).
Суммарные затраты на тепловую энергию
Определяются как произведение полей Суммарная тепловая нагрузка,
Гкал/ч и Стоимость тепловой энергии.
Затраты на тепловые потери в трубопроводах
Определяются как произведение полей Тепловые потери в тепловых сетях,
Гкал/ч и Стоимость тепловой энергии.
Расчет затрат
Для расчета затрат на тепловую и электроэнергию следует:
Добавить поля в БД. Для добавления полей в структуру слоя надо Обновить структуру таблиц.
В настройках расчетов на вкладке протокол расчёта включить опцию Вычислять затраты на тепло и электроэнергию.
Внести в поля на насосах исходные данные:
Внести в поля на источнике исходные данные:
Стоимость тепловой энергии (Cost_q)Стоимость электроэнергии (Cost_w)— указывается стоимость электрической энергии.
Провести поверочный расчет.
Смотрите также:
что это, расчёт, формула, вид квитанции
Получая по почте платёжные документы, многие не понимают – «тепловая энергия» в квитанции: что это, как она рассчитывается. Данный показатель означает нагрев отопительных приборов, за который взимается плата по тарифу. Но если в квитанции начинают появляться странные значения и переплата, редакция Homius расскажет, как высчитать норму ГВС самостоятельно.
Тарифы на ГВС отличаются в разных регионахФОТО: biz.liga.net
Содержание статьи
Что такое тепловая энергия
При выборе источника тепла в помещении учитывается нагрузка на систему горячего водоснабжения. Многие домовладельцы не знают, что такое ГВС компонент на тепловую энергию. Это показатель, означающий норму расхода воды.
Сегодня все пользуются горячей и холодной водой, но не все знают, что такое «тепловая энергия» в квитанции ЖКХ. Если дом холодный, значит, тепловая энергия не подаётся в должном объёме. Это повод для обращения в управляющую компанию и подачи соответствующей жалобы.
Если дом холодный, значит, тепловая энергия не подаётся в должном объёме. Это повод для обращения в управляющую компанию и подачи соответствующей жалобы.
Перед тем, как приступать к самостоятельным расчётам, нужно выяснить, что значит ГВС-компонент на ТЭ, как его рассчитать и вообще что это за коэффициент в тарифе. Когда мы видим в квитанции словосочетание «За нагрев воды», то не все понимают, что именно складывается за этой услугой. А между тем этот показатель был введён в 2013 году.
Сумма к оплате включает в себя несколько составляющих:
- потеря тепла в трубах;
- действующий тариф на энергию;
- расходы на содержание батарей и центральной тепловой системы;
- расходы на транспортировку горячей воды.
Самый простой способ узнавать точные показатели – установить счётчик. Также многие собственники задаются вопросом: что это такое – «подогрев воды» в квитанции ЖКХ. Это услуга, предоставляемая управляющей компанией по поставке тёплой воды в дома.
ФОТО: static.ngs.ruГВС в квитанции делится на два пункта – подача и нагрев
ФОТО: i0.u-mama.ru
ГКАЛ: что это такое
ГВС – это расшифровка термина «горячее водоснабжение», но, кроме этого показателя, необходимо знать ГВС в ГКАЛ. Что это такое и как определяется? Коммунальными службами единица тепла определяется в ГКАЛ. Эта аббревиатура расшифровывается: гигакалории. Этот показатель утверждён Национальной комиссией. В стоимость одного ГКАЛ входит ремонт оборудования, цена электричества, газа и другие организационные расходы.
Чтобы высчитать объём тепла, нужно определить общее количество потребляемой жидкости, температуру горячей и холодной воды. Также нужно знать, что такое «теплоноситель» в квитанции, чтобы не запутаться в данных. Теплоноситель – это плата за тариф из двух компонентов: вода и полотенцесушители. Система расчёта проста – в управляющей компании берётся за основу общий тариф или показатель, предоставленный потребителем по счётчикам. Если в доме установлены тепловые счётчики, показатели в квитанциях будут максимально точны.
Если в доме установлены тепловые счётчики, показатели в квитанциях будут максимально точны.
ФОТО: rbsmi.ru
Закон об изменении тарифов на горячую воду
В 2013 году было принято Постановление Правительства Российской Федерации №406, на основании которого со всех пользователей централизованной системы отопления стала взиматься плата по двухкомпонентному тарифу. Так, коммунальный платёж включает в себя графы: холодная вода, тепловая энергия.
В нормативных документах указано чёткое определение по данному вопросу. ГВС в квитанции – это показатель, который управляющие компании планируют затрачивать при нагреве воды.
До 2013 года в квитанциях не учитывался нагрев полотенцесушителей и стояков, но после принятия закона эти показатели добавились к общей сумме. Также стоит уточнить, что такое «ГВС нагрев» в квитанции. Под нагревом подразумевается поставка холодной воды на отопительное предприятие и её подогрев.
В квитанции обозначается компонент на воду в рублях за кубометрФОТО: vesti70.
 ruДля экономии рекомендуется устанавливать индивидуальные приборы учёта
ruДля экономии рекомендуется устанавливать индивидуальные приборы учётаФОТО: komcity.ru
Компонент на тепловую энергию: что это, как рассчитать
Большинство домовладельцев пугаются, увидев в платёжном документе графу «компонент на холодную воду». Сначала нужно разобраться, «ГВС компонент на теплоноситель» – что это? Это общий объём холодной воды, которая нужна для того, чтобы полностью обеспечить нужды горячего водоснабжения.
Если в доме отсутствует индивидуальный прибор учёта, расчёт ведётся по нормативам – 3,5 м³ на одного человека. При возникновении ошибки необходимо обратиться в управляющую компанию, уточнив тарифы на текущий год. Тариф ежемесячно обозначается в квитанции.
Ежемесячно потребители передают данные с приборов учёта в управляющую компаниюФОТО: dagpravda.ru
Какое оборудование используется для нагрева воды
Прежде чем начинать самостоятельные расчёты, нужно понять, что означает «тепловая энергия» в квитанции. Вода поставляется на централизованные пункты в холодном виде, и только при работе специального оборудования формируется горячий поток. Услуга ГВС – это поставка пара в отопительные трубы и воды в краны.
Услуга ГВС – это поставка пара в отопительные трубы и воды в краны.
Задаваясь вопросом, отопление ГКАЛ – что это в квитанции, многие так же желают знать, какое оборудование используется для нагрева воды. В городских квартирах используются водонагреватели.
При этом некоторые собственники устанавливают в квартирах устройство для индивидуального нагрева и пытаются понять, что это такое – «подогрев ГВС» в квитанции, почему за него нужно платить. УК формируют квитанции на весь дом, и, если в одной из квартир стоит отопительное оборудование, осуществляющее подогрев воды, необходимо написать заявление для перерасчёта.
Если установлен единый водонагреватель на дом, за обслуживание и ремонт платят все жильцыФОТО: dvinatoday.ru
Тепловая энергия ГВС: что это, где находится в квитанции
Для тех собственников, которые не знают, что такое тепловая энергия в квитанции, существует простая схема. В документе нужно найти фразу «компонент «тепловая энергия» и изучить тариф.
Компонент – это холодная вода, при нагреве которой в квартиру подаётся отопление.
Задавая вопрос: горячее водоснабжение энергия – что это такое, нужно изучить схему, по которой определяется общий платёж.
В этот показатель входят следующие данные: общий тариф, расходы на обслуживание и ремонт, ставка на потерю тепла и расходы на передачу теплоносителя.
Общее количество тепловой энергии может отличаться в разные месяцы, поэтому лучше всего использовать индивидуальные приборы учётаФОТО: nsktv.ru
Особенности самостоятельного расчёта
Не все пользователи знают, что такое «теплоэнергия ГВС» в квитанции, а многие не доверяют расчётному центру и самостоятельно подсчитывают количество затраченной тепловой энергии. Чтобы в домашних условиях все посчитать и исключить обман, нужно сначала выяснить: компонент на ТЭ в квитанции – что это, как он начисляется.
Чтобы сделать правильный расчёт, необходимо знать действующий тариф на ТЭ. Отсутствие или наличие прибора учёта, установленного в квартире, также влияет на результат. Если счётчиков нет, за основу берётся нормативный показатель.
Если в многоквартирном доме стоят приборы учёта, то общая сумма высчитывается умножением тарифа на показатели счётчиков. Каждый может быстро выяснить, «горячее водоснабжение: носитель» и «энергия» – что это, как правильно высчитать показатели.
Подавать данные со счётчиков можно онлайнФОТО: fednews.ruТариф на ТЭ указывается в квитанции
ФОТО: zvu-74.ru
Подача жалобы при неправильном расчёте в квитанции
Если после самостоятельного расчёта и определения «ГВС тепловая энергия» в квитанции заметна ошибка, необходимо обратиться в управляющую компанию и потребовать разъяснений. В случае, если сотрудник не может объяснить за что поступила оплата, как работает теплоноситель и почему было начислено именно это количество выплаты, гражданин имеет право подать письменную претензию.
На такой документ УК обязана отреагировать в течение 13 рабочих дней. В случае, если ответ не поступает по завершению этого срока, а потребитель не может понять, за что он переплачивает, нужно переходить к следующему шагу – подаче иска в прокуратуру и суд.
Граждане РФ имеют право отстаивать свои интересы, если они были нарушены. Суд определит, почему горячая вода в квитанции стоит дороже, чем по действующим расценкам и, при подтверждении ошибки, назначит возврат средств.
Плата за тепловую энергию взимается на основании ЖК РФ, данная услуга не является бесплатнойФОТО: kpravda.ruНеобходимо получить письменный отказ в предоставлении расчёта от управляющей компании
ФОТО: economnavode.ru
В заключение
Нередко при получении квитанции обнаруживаются ошибки в расчётах, допущенные управляющей компанией. Каждый гражданин имеет право в таком случае получить возврат средств.
А вы проверяете данные, указанные в квитанции? Приходилось ли вам подавать заявление на перерасчёт?
ПредыдущаяDIY HomiusНаполнитель для подушек: какой лучше, плюсы и минусы искусственных и натуральных материалов
СледующаяШторыОсобенности выбора и монтажа потолочных карнизов для штор
Понравилась статья? Сохраните, чтобы не потерять!
ТОЖЕ ИНТЕРЕСНО:
ВОЗМОЖНО ВАМ ТАКЖЕ БУДЕТ ИНТЕРЕСНО:
Изменились ли формулы расчёта платы за отопление: объясняет юрист
С 1 января 2019 года начали действовать новые формулы расчёта платы за отопление. Вид у них, мягко скажем, отпугивающий. Наш постоянный эксперт Елена Шерешовец объяснила, как изменились формулы расчёта платы за отопление и кому не понравятся нововведения.
Вид у них, мягко скажем, отпугивающий. Наш постоянный эксперт Елена Шерешовец объяснила, как изменились формулы расчёта платы за отопление и кому не понравятся нововведения.
Как в 2019 году изменилась система расчётов платы за отопление МКД
Что случилось
Елена Шерешовец рассказывает, на самом ли деле изменились формулы
Постановление Правительства РФ от 28.12.2018 № 1708 года внесло изменения в Правила предоставления коммунальных услуги утвердило новые формулы расчёта платы за отопление.
Для домов, которые не оборудованы общедомовыми приборами учёта, действуют две формулы: формула 2(3) для расчёта размера платы за отопление равномерно в течение года и формула 2(4) для расчёта платы в отопительный период.
Если в доме установлен общедомовый прибор учёта, расчёт размера платы будет зависеть от наличия в доме индивидуальных счётчиков тепла. Если индивидуальных приборов нет, расчёт производится по формуле 3, она переписана в новом виде.
Если помещения оборудованы индивидуальными приборами учёта частично, работает формула 3(1), это новая формула. Когда все помещения оборудованы ИПУ, расчёт ведётся по формуле 3(3), которая переписана.
Вот как это выглядит в виде схемы:
На первый взгляд кажется, что формулы сильно изменились. Елена Шерешовец уточняет, что формулы поменялись только для многоквартирных домов, где есть помещения, которые отказались от централизованного отопления и перешли на индивидуальные источники тепла или где есть помещения, которые не являются общим имуществом. В этих помещениях в принципе не предусмотрено наличие приборов отопления.
Для домов, где таких помещений нет, всё осталось без изменений. Рассмотрим на примерах.
Почему КС РФ потребовал пересмотреть систему расчётов за отопление
Дом не оборудован ОДПУ или используются ИПУ
Формула 2(3) предназначена для расчёта отопления в многоквартирном доме, не оборудованном общедомовым прибором учёта.
Если в МКД нет помещений, где не предусмотрены приборы отопления или используются индивидуальные источники отопления, то Sинд равна нулю. В таком случае формула приобретает прежний вид:
Вот как это получилось:
Настоящий квест для ценителей математических расчётов
Дом оборудован ОДПУ, индивидуальных приборов учёта нет
Для расчёта платы за отопление в домах, которые оборудованы общедомовым прибором учёта тепла, но индивидуальных приборов учёта там нет, действует формула 3.
Если в таком многоквартирном доме нет помещений с автономным отоплением, то Sинд становится равна нулю, и формула приобретает прежний вид. Это действует и для регионов, где расчёт ведётся равномерно в течение отопительного сезона, и для регионов, где начисления производятся только в отопительный период.
Посмотрите, как это получилось:
Взыскание задолженности за отопление при отсутствии радиаторов
Дом оборудован ОДПУ и хотя бы в одном помещении есть ИПУ
Для случая, когда многоквартирный дом оборудован общедомовым прибором учёта тепловой энергии и хотя бы в одном, но не во всех жилых и нежилых помещениях установлены индивидуальные приборы учёта тепловой энергии, предусмотрена новая формула:
Размер платы за отопление складывается из двух частей:
- Vi – это плата за тепловую энергию, потреблённую в помещении;
- страшная дробь – плата за тепловую энергию, потреблённую на общедомовые нужды.
Если индивидуальными приборами учёта оборудовано небольшое количество помещений, то числитель дроби получается большим, в таком случае размер платы за ОДН тоже увеличивается.
Елена Шерешовец объяснила, что в определённом случае есть опасность применить эту новую формулу и получить отрицательное значение ОДН. Так происходит, когда кто-либо из потребителей неправильно передаст показания – завысит их. Это может случиться вследствие технической ошибки или человеческого фактора.
По нашей новой формуле при расчете общедомовой платы от Vд – это объём тепловой энергии по показаниям общедомового прибора – отнимается сумма всех показаний индивидуальных приборов учёта. Если кто-то из потребителей ошибётся с показаниями, средний расход за помещения с ИПУ превысит средний расход по дому. Получится отрицательное значение. ОДН будет отрицательный.
Делаем вывод – необходимо постоянно контролировать и проверять корректность переданных показаний, даже если они снимаются в автоматическом режиме.
Что такое калория: перевод Гкал в кВт и МВт, как рассчитывают тепловую энергию на горячую воду и отопление
Каждый, хотя бы косвенно, но знаком с таким понятием как «калория». Что это и для чего она нужна? Что именно она обозначает? Такие вопросы возникают, особенно, если нужно её увеличить до килокалорий, мегакалорий или гигакалорий, или перевести в другие величины, например Гкал в кВт.
Что собой представляет калория
Калория не входит в международную систему измерений метрических величин, однако это понятие широко используется для обозначения количества выделенной энергии. Она указывает, сколько энергии должно быть затрачено на обогрев 1 г воды так, чтобы данный объём увеличил температуру на 1 °C в стандартных условиях.
Существует 3 общепринятых обозначения, каждое из которых используют в зависимости от области:
- Международное значение калории, которое равняется 4,1868 Дж (Джоуль), и обозначается как «кал» в Российской Федерации и cal – в мире;
- В термохимии – относительная величина, примерно равная 4,1840 Дж с российским обозначением калтх и всемирным – calth;
- 15-градусный показатель калории, равный приблизительно 4,1855 Дж, который в России известен как «кал15», а в мире – cal15.
Изначально калорию использовали для нахождения количество теплоты, выделенной при выработке энергии топлива. Впоследствии данную величину стали использовать для вычисления количества энергии, затраченной спортсменом при выполнении любой физической нагрузки, поскольку при данных действиях применимы те же физические законы.
Поскольку для выделения тепла необходимо топливо, то по аналогии с теплоэнергетикой в простой жизни для выработки энергии организмом также необходима «заправка» – пища, которую люди принимают регулярно.
Человек получает определённое количество калорий, в зависимости от того, какой продукт употребил.
Чем больше калорий в виде пищи человек получил, тем больше он получает энергии для занятий спортом. Однако не всегда люди потребляют количество калорий, которое необходимо для поддержания жизненных процессов организма в норме и выполнения физической нагрузки. В результате чего одни худеют (при дефиците калорий), а другие – набирают вес.
Калорийность — это количество энергии, полученной человеком в результате поглощения того или иного продукта
На основе этой теории построено множество принципов диет и правил здорового питания. Оптимальное количество энергии и макронутриентов, которые необходимы человеку в день, можно рассчитать в соответствии с формулами известных диетологов (Харрис-Бенедикт, Миффлин-Сан Жеор), используя стандартные параметры:
- Возраст;
- Рост;
- Вес;
- Пример суточной активности;
- Образ жизни.
Эти данные можно использовать изменяя их под себя – для безболезненного похудения достаточно создать дефицит в 15-20% от суточной калорийности, а для здорового набора массы – аналогичный профицит.
Что такое Гигакалория, и сколько в ней калорий
Понятие Гигакалории наиболее часто встречается в документах области теплоэнергетики. Данную величину можно встретить в квитанциях, извещениях, платежах за отопление и горячую воду.
Она обозначает то же самое, что и калория, но в большем объёме, о чем свидетельствует приставка «Гига». Гкал определяет, что исходную величину умножили на 109. Говоря простым языком: в 1 Гигакалории – 1 миллиард калорий.
Как и калория, Гигакалория не относится к метрической системе физических величин.
В таблице ниже для примера приведено сравнение величин:
| Приставка | Количество калорий |
| ккал (килокалория) | 1 000 |
| Мкал (мегакалория) | 1 000 000 |
| Гкал (гигакалория) | 1 000 000 000 |
Необходимость использования Гкал обусловлена тем, что при нагреве объёма воды, нужного для обогрева и бытовых нужд населения даже 1 жилого дома выделяется колоссальное количество энергии. Писать числа, обозначающие её в документах, в формате калорий слишком долго и неудобно.
Такую величину, как гигакалорию, можно встретить в платёжных документах за отопление
Можно представить, сколько энергии затрачивается во время отопительного сезона в промышленных масштабах: при отоплении 1 квартала, района, города, страны.
Гкал и Гкал/ч: в чём разница
При необходимости расчёта оплаты потребителем услуг государственной теплоэнергетики (отопление дома, горячая вода) используется такая величина как Гкал/ч. Она обозначает привязку ко времени – сколько Гигакалорий расходуется при обогреве за данный промежуток времени. Иногда её также заменяют Гкал/м3 (сколько энергии нужно для передачи тепла кубическому метру воды).
Величину Гкал/ч можно рассчитать самостоятельно, используя данную формулу:
Q=V*(T1 – T2)/1000, где
- Q – количество тепловой энергии;
- V – объём потребления жидкости в кубических метрах/тоннах;
- T1 – температура поступаемой горячей жидкости, которая измеряется в градусах по Цельсию;
- T2 – температура поступаемой холодной жидкости по аналогии с предыдущим показателем;
- 1000 – вспомогательный коэффициент, который упрощает подсчёты, избавляя от чисел в десятом разряде (автоматически переводит ккал в Гкал).
Данную формулу часто используют для построения принципа работы тепловых счётчиков на частных квартирах, домах или предприятиях. Данная мера необходима при резком росте стоимости данной коммунальной услуги особенно, когда подсчёты обобщаются из расчёта на площадь/объём помещения, которое нагревают.
В случае, если в помещении установлена система закрытого типа (горячая жидкость заливается в неё единоразово без дополнительного поступления воды), формулу модифицируют:
Q= (( V1* (T1 – T2)) – (V2* (T2 – T)))/ 1000, где
- Q – количество тепловой энергии;
- V1 – объём расходуемого теплового вещества (вода/газ) в трубопроводе, по которому оно поступает в систему;
- V2 – объём теплового вещества в трубопроводе, по которому оно возвращается обратно;
- T1 – температура в градусах Цельсия в трубопроводе на входе;
- T2 – температура в градусах Целься в трубопроводе на выходе;
- T – температура холодной воды;
- 1000 – вспомогательный коэффициент.
Данная формула основана на разности величин на входе и выходе теплоносителя в помещении.
В зависимости от использования того или иного источника энергии, а также – типа теплового вещества (вода, газ), применяют также альтернативные формулы расчётов:
- Q= (( V1* (T1 – T2)) + (V1 – V2)*( T2 – T))/1000
- Q= (( V2* (T1 – T2)) + (V1 – V2)*(T1 – T))/1000
Кроме того, формула меняется, если в систему включены электрические устройства (например полы с подогревом).
Как рассчитываются Гкал на горячую воды и отопление
Отопление рассчитывается по формулам, аналогичным формулам нахождения величины Гкал/ч.
Примерная формула подсчёта оплаты за тёплую воду в жилых помещениях:
P i гв = Vi гв * T х гв + (V v кр * Vi гв / ∑ Vi гв * T v кр)
Используемые величины:
- P i гв – искомая величина;
- V i гв – объём потребления горячей воды за определённый временной промежуток;
- T х гв – установленная тарифная плата за горячее водоснабжение;
- V v гв – объём затраченной энергии компанией, которая занимается её подогревом и поставкой в жилое/нежилое помещение;
- ∑ V i гв – сумма потребления тёплой воды во всех помещениях дома, в котором производится расчет;
- T v гв – тарифная плата за тепловую энергию.
В данной формуле не учитывается показатель атмосферного давления, поскольку он не существенно влияет на конечную искомую величину.
Формула приблизительная и не подходит для самостоятельного расчёта без предварительной консультации. Перед её использованием необходимо обратиться к местным коммунальным службам для уточнения и корректировки – возможно, они пользуются другими параметрами и формулами для расчёта.
Расчёт размера платы за отопление является очень важным, так как зачастую внушительные суммы не оправданы
Результат расчётов зависит не только от относительных температурных величин – на него напрямую влияют установленные правительством тарифы на потребление горячего водоснабжения и отопления помещений.
Вычислительный процесс значительно упрощается, если установить отопительный счётчик на квартиру, подъезд или жилой дом.
Стоит учитывать, что даже самые точные счётчики могут допускать погрешность при вычислениях. Также её можно определить по формуле:
E = 100 *((V1 – V2)/(V1 + V2))
В представленной формуле используются следующие показатели:
- E – погрешность;
- V1 – объём потребляемого горячего водоснабжения при поступлении;
- V2 – потребляемая горячая вода на выходе;
- 100 – вспомогательный коэффициент, преобразующий результат в проценты.
В соответствии с требованиями, средняя величина погрешности расчётного прибора составляет около 1 %, а максимально допустимая – 2 %.
Видео: пример расчёта платы за отопление
Как перевести Гкал в кВт/ч и Гкал/ч в кВт
На различных устройствах сферы теплоэнергетики указывают различные метрические величины. Так, на отопительных котлах и обогревателях чаще указывают киловатт и киловатт в час. На счётных приборах (счётчиках) чаще встречаются Гкал. Разница в величинах мешает правильному расчёту искомой величины по формуле.
Чтобы облегчить расчётный процесс, необходимо научиться переводить одну величину в другую и наоборот. Поскольку величины имеют постоянное значение, то это несложно – 1 Гкал/ч равен 1162,7907 кВт.
Если величина представлена в мегаваттах, её можно перевести обратно в Гкал/ч, умножив на постоянное значение 0,85984.
Ниже представлены вспомогательные таблицы, позволяющие быстро переводить величины из одной в другую:
| Гкал | кВт/ч |
| 1 | 1163 |
| 2 | 2326 |
| 3 | 3489 |
| 4 | 4652 |
| 5 | 5815 |
| 10 | 11630 |
| 15 | 17445 |
| 20 | 23260 |
Таблица обратная предыдущей:
| кВт | Гкал/ч |
| 1 000 | 0,85984 |
| 5 000 | 4,29922 |
| 10 000 | 8,5984 |
| 30 000 | 25,795 |
| 50 000 | 42,992 |
| 100 000 | 85,984 |
| 500 000 | 429,9226 |
| 1 000 000 | 859,8452 |
Использование данных таблиц значительно упростит процесс расчёта стоимости тепловой энергии. Кроме того, для упрощения действий, можно воспользоваться одним из предложенных в сети Интернет онлайн-конвертеров, преобразующих физические величины одна в другую.
Самостоятельный расчёт потребляемой энергии в Гигакалориях позволит владельцу жилого/нежилого помещения контролировать стоимость коммунальных услуг, а также – работу коммунальных служб. С помощью проведения простых подсчётов появляется возможность сверить результаты с аналогичными в получаемых платёжных квитанциях и обратиться в соответствующие органы в случае разности показателей.
Оцените статью: Поделитесь с друзьями!Количество теплоты и тепловая мощность. Расчет в Excel.
Опубликовано 13 Окт 2013
Рубрика: Теплотехника | 104 комментария
Человечеству известно немного видов энергии – механическая энергия (кинетическая и потенциальная), внутренняя энергия (тепловая), энергия полей (гравитационная, электромагнитная и ядерная), химическая. Отдельно стоит выделить энергию взрыва,…
…энергию вакуума и еще существующую только в теории – темную энергию. В этой статье, первой в рубрике «Теплотехника», я попытаюсь на простом и доступном языке, используя практический пример, рассказать о важнейшем виде энергии в жизни людей — о тепловой энергии и о рождающей ее во времени тепловой мощности.
Несколько слов для понимания места теплотехники, как раздела науки о получении, передаче и применении тепловой энергии. Современная теплотехника выделилась из общей термодинамики, которая в свою очередь является одним из разделов физики. Термодинамика – это дословно «теплый» плюс «силовой». Таким образом, термодинамика – это наука об «изменении температуры» системы.
Воздействие на систему извне, при котором изменяется ее внутренняя энергия, может являться результатом теплообмена. Тепловая энергия, которая приобретается или теряется системой в результате такого взаимодействия с окружающей средой, называется количеством теплоты и измеряется в системе СИ в Джоулях.
Если вы не инженер-теплотехник, и ежедневно не занимаетесь теплотехническими вопросами, то вам, столкнувшись с ними, иногда без опыта бывает очень трудно быстро в них разобраться. Трудно без наличия опыта представить даже размерность искомых значений количества теплоты и тепловой мощности. Сколько Джоулей энергии необходимо чтобы нагреть 1000 метров кубических воздуха от температуры -37˚С до +18˚С?.. Какая нужна мощность источника тепла, чтобы сделать это за 1 час?.. На эти не самые сложные вопросы способны сегодня ответить «сходу» далеко не все инженеры. Иногда специалисты даже помнят формулы, но применить их на практике могут лишь единицы!
Прочитав до конца эту статью, вы сможете легко решать реальные производственные и бытовые задачи, связанные с нагревом и охлаждением различных материалов. Понимание физической сути процессов теплопередачи и знание простых основных формул – это главные блоки в фундаменте знаний по теплотехнике!
Количество теплоты при различных физических процессах.
Большинство известных веществ могут при разных температуре и давлении находиться в твердом, жидком, газообразном или плазменном состояниях. Переход из одного агрегатного состояния в другое происходит при постоянной температуре (при условии, что не меняются давление и другие параметры окружающей среды) и сопровождается поглощением или выделением тепловой энергии. Не смотря на то, что во Вселенной 99% вещества находится в состоянии плазмы, мы в этой статье не будем рассматривать это агрегатное состояние.
Рассмотрим график, представленный на рисунке. На нем изображена зависимость температуры вещества Т от количества теплоты Q, подведенного к некой закрытой системе, содержащей определенную массу какого-то конкретного вещества.
1. Твердое тело, имеющее температуру T1, нагреваем до температуры Tпл, затрачивая на этот процесс количество теплоты равное Q1.
2. Далее начинается процесс плавления, который происходит при постоянной температуре Тпл (температуре плавления). Для расплавления всей массы твердого тела необходимо затратить тепловой энергии в количестве Q2— Q1.
3. Далее жидкость, получившаяся в результате плавления твердого тела, нагреваем до температуры кипения (газообразования) Ткп, затрачивая на это количество теплоты равное Q3—Q2.
4. Теперь при неизменной температуре кипения Ткп жидкость кипит и испаряется, превращаясь в газ. Для перехода всей массы жидкости в газ необходимо затратить тепловую энергию в количестве Q4—Q3.
5. На последнем этапе происходит нагрев газа от температуры Ткп до некоторой температуры Т2. При этом затраты количества теплоты составят Q5—Q4. (Если нагреем газ до температуры ионизации, то газ превратится в плазму.)
Таким образом, нагревая исходное твердое тело от температуры Т1 до температуры Т2 мы затратили тепловую энергию в количестве Q5, переводя вещество через три агрегатных состояния.
Двигаясь в обратном направлении, мы отведем от вещества то же количество тепла Q5, пройдя этапы конденсации, кристаллизации и остывания от температуры Т2 до температуры Т1. Разумеется, мы рассматриваем замкнутую систему без потерь энергии во внешнюю среду.
Заметим, что возможен переход из твердого состояния в газообразное состояние, минуя жидкую фазу. Такой процесс именуется возгонкой, а обратный ему процесс – десублимацией.
Итак, уяснили, что процессы переходов между агрегатными состояниями вещества характеризуются потреблением энергии при неизменной температуре. При нагреве вещества, находящегося в одном неизменном агрегатном состоянии, повышается температура и также расходуется тепловая энергия.
Главные формулы теплопередачи.
Формулы очень просты.
Количество теплоты Q в Дж рассчитывается по формулам:
1. Со стороны потребления тепла, то есть со стороны нагрузки:
1.1. При нагревании (охлаждении):
Q=m*c*(Т2-Т1)
Здесь и далее:
m – масса вещества в кг
с – удельная теплоемкость вещества в Дж/(кг*К)
1.2. При плавлении (замерзании):
Q=m*λ
λ – удельная теплота плавления и кристаллизации вещества в Дж/кг
1.3. При кипении, испарении (конденсации):
Q=m*r
r – удельная теплота газообразования и конденсации вещества в Дж/кг
2. Со стороны производства тепла, то есть со стороны источника:
2.1. При сгорании топлива:
Q=m*q
q – удельная теплота сгорания топлива в Дж/кг
2.2
t – время в с
I – действующее значение тока в А
U – действующее значение напряжения в В
R – сопротивление нагрузки в Ом
Делаем вывод – количество теплоты прямо пропорционально массе вещества при всех фазовых превращениях и при нагреве дополнительно прямо пропорционально разности температур. Коэффициенты пропорциональности (c, λ, r, q) для каждого вещества имеют свои значения и определены опытным путем (берутся из справочников).
Тепловая мощность N в Вт – это количество теплоты переданное системе за определенное время:
N=Q/t
Чем быстрее мы хотим нагреть тело до определенной температуры, тем большей мощности должен быть источник тепловой энергии – все логично.
Расчет в Excel прикладной задачи.
В жизни бывает часто необходимо сделать быстрый оценочный расчет, чтобы понять – имеет ли смысл продолжать изучение темы, делая проект и развернутые точные трудоемкие расчеты. Сделав за несколько минут расчет даже с точностью ±30%, можно принять важное управленческое решение, которое будет в 100 раз более дешевым и в 1000 раз более оперативным и в итоге в 100000 раз более эффективным, чем выполнение точного расчета в течение недели, а то и месяца, группой дорогостоящих специалистов…
Условия задачи:
В помещение цеха подготовки металлопроката размерами 24м х 15м х 7м завозим со склада на улице металлопрокат в количестве 3т. На металлопрокате есть лед общей массой 20кг. На улице -37˚С. Какое количество теплоты необходимо, чтобы нагреть металл до +18˚С; нагреть лед, растопить его и нагреть воду до +18˚С; нагреть весь объем воздуха в помещении, если предположить, что до этого отопление было полностью отключено? Какую мощность должна иметь система отопления, если все вышесказанное необходимо выполнить за 1час? (Очень жесткие и почти не реальные условия – особенно касающиеся воздуха!)
Расчет выполним в программе MS Excel или в программе OOo Calc.
С цветовым форматированием ячеек и шрифтов ознакомьтесь на странице «О блоге».
Исходные данные:
1. Названия веществ пишем:
в ячейку D3: Сталь
в ячейку E3: Лед
в ячейку F3: Лед/вода
в ячейку G3: Вода
в ячейку G3: Воздух
2. Названия процессов заносим:
в ячейки D4, E4, G4, G4: нагрев
в ячейку F4: таяние
3. Удельную теплоемкость веществ c в Дж/(кг*К) пишем для стали, льда, воды и воздуха соответственно
в ячейку D5: 460
в ячейку E5: 2110
в ячейку G5: 4190
в ячейку H5: 1005
4. Удельную теплоту плавления льда λ в Дж/кг вписываем
в ячейку F6: 330000
5. Массу веществ m в кг вписываем соответственно для стали и льда
в ячейку D7: 3000
в ячейку E7: 20
Так как при превращении льда в воду масса не изменяется, то
в ячейках F7 и G7: =E7=20
Массу воздуха находим произведением объема помещения на удельный вес
в ячейке H7: =24*15*7*1,23=3100
6. Время процессов t в мин пишем только один раз для стали
в ячейку D8: 60
Значения времени для нагрева льда, его плавления и нагрева получившейся воды рассчитываются из условия, что все эти три процесса должны уложиться в сумме за такое же время, какое отведено на нагрев металла. Считываем соответственно
в ячейке E8: =E12/(($E$12+$F$12+$G$12)/D8)=9,7
в ячейке F8: =F12/(($E$12+$F$12+$G$12)/D8)=41,0
в ячейке G8: =G12/(($E$12+$F$12+$G$12)/D8)=9,4
Воздух также должен прогреться за это же самое отведенное время, читаем
в ячейке H8: =D8=60,0
7. Начальную температуру всех веществ T1 в ˚C заносим
в ячейку D9: -37
в ячейку E9: -37
в ячейку F9: 0
в ячейку G9: 0
в ячейку H9: -37
8. Конечную температуру всех веществ T2 в ˚C заносим
в ячейку D10: 18
в ячейку E10: 0
в ячейку F10: 0
в ячейку G10: 18
в ячейку h20: 18
Думаю, вопросов по п.7 и п.8 быть недолжно.
Результаты расчетов:
9. Количество теплоты Q в КДж, необходимое для каждого из процессов рассчитываем
для нагрева стали в ячейке D12: =D7*D5*(D10-D9)/1000=75900
для нагрева льда в ячейке E12: =E7*E5*(E10-E9)/1000= 1561
для плавления льда в ячейке F12: =F7*F6/1000= 6600
для нагрева воды в ячейке G12: =G7*G5*(G10-G9)/1000= 1508
для нагрева воздуха в ячейке h22: =H7*H5*(h20-H9)/1000= 171330
Общее количество необходимой для всех процессов тепловой энергии считываем
в объединенной ячейке D13E13F13G13h23: =СУММ(D12:h22) = 256900
В ячейках D14, E14, F14, G14, h24, и объединенной ячейке D15E15F15G15h25 количество теплоты приведено в дугой единице измерения – в ГКал (в гигакалориях).
10. Тепловая мощность N в КВт, необходимая для каждого из процессов рассчитывается
для нагрева стали в ячейке D16: =D12/(D8*60)=21,083
для нагрева льда в ячейке E16: =E12/(E8*60)= 2,686
для плавления льда в ячейке F16: =F12/(F8*60)= 2,686
для нагрева воды в ячейке G16: =G12/(G8*60)= 2,686
для нагрева воздуха в ячейке h26: =h22/(H8*60)= 47,592
Суммарная тепловая мощность необходимая для выполнения всех процессов за время t рассчитывается
в объединенной ячейке D17E17F17G17h27: =D13/(D8*60) = 71,361
В ячейках D18, E18, F18, G18, h28, и объединенной ячейке D19E19F19G19h29 тепловая мощность приведена в дугой единице измерения – в Гкал/час.
На этом расчет в Excel завершен.
Выводы:
Обратите внимание, что для нагрева воздуха необходимо более чем в два раза больше затратить энергии, чем для нагрева такой же массы стали.
При нагреве воды затраты энергии в два раза больше, чем при нагреве льда. Процесс плавления многократно больше потребляет энергии, чем процесс нагрева (при небольшой разности температур).
Нагрев воды в десять раз затрачивает больше тепловой энергии, чем нагрев стали и в четыре раза больше, чем нагрев воздуха.
Для получения информации о выходе новых статей и для скачивания рабочих файлов программ прошу вас подписаться на анонсы в окне, расположенном в конце статьи или в окне вверху страницы.
После ввода адреса своей электронной почты и нажатия на кнопку «Получать анонсы статей» НЕ ЗАБУДЬТЕ ПОДТВЕРДИТЬ ПОДПИСКУ кликом по ссылке в письме, которое тут же придет к вам на указанную почту (иногда — в папку «Спам»)!
Мы вспомнили понятия «количество теплоты» и «тепловая мощность», рассмотрели фундаментальные формулы теплопередачи, разобрали практический пример. Надеюсь, что мой язык был прост, понятен и интересен.
Жду вопросы и комментарии на статью!
Прошу УВАЖАЮЩИХ труд автора скачать файл ПОСЛЕ ПОДПИСКИ на анонсы статей.
Ссылка на скачивание файла: raschet-teplovoy-moshchnosti (xls 19,5KB).
Другие статьи автора блога
На главную
Статьи с близкой тематикой
Отзывы
Формула количества теплоты в физике
Содержание:
Определение и формула количества теплоты
Внутреннюю энергию термодинамической системы можно изменить двумя способами:
- совершая над системой работу,
- при помощи теплового взаимодействия.
Передача тепла телу не связана с совершением над телом макроскопической работы. В данном случае изменение внутренней энергии вызвано тем, что отдельные молекулы тела с большей температурой совершают работу над некоторыми молекулами тела, которое имеет меньшую температуру. В этом случае тепловое взаимодействие реализуется за счет теплопроводности. Передача энергии также возможна при помощи излучения. Система микроскопических процессов (относящихся не ко всему телу, а к отдельным молекулам) называется теплопередачей. Количество энергии, которое передается от одного тела к другому в результате теплопередачи, определяется количеством теплоты, которое предано от одного тела другому.
Определение
Теплотой называют энергию, которая получается (или отдается) телом в процессе теплообмена с окружающими телами (средой). Обозначается теплота, обычно буквой Q.
Это одна из основных величин в термодинамике. Теплота включена в математические выражения первого и второго начал термодинамики. Говорят, что теплота – это энергия в форме молекулярного движения.
Теплота может сообщаться системе (телу), а может забираться от нее. Считают, что если тепло сообщается системе, то оно положительно.
Формула расчета теплоты при изменении температуры
Элементарное количество теплоты обозначим как $\delta Q$. Обратим внимание, что элемент тепла, которое получает (отдает) система при малом изменении ее состояния не является полным дифференциалом. Причина этого состоит в том, что теплота является функцией процесса изменения состояния системы.
Элементарное количество тепла, которое сообщается системе, и температура при этом меняется от Tдо T+dT, равно:
$$\delta Q=C d T(1)$$где C – теплоемкость тела. Если рассматриваемое тело однородно, то формулу (1) для количества теплоты можно представить как:
$$\delta Q=c m d T=\nu c_{\mu} d T(2)$$где $c=\frac{C}{m}$ – удельная теплоемкость тела, m – масса тела, $c_{\mu}=c \cdot \mu$ — молярная теплоемкость, $\mu$ – молярная масса вещества, $\nu=\frac{m}{\mu}$ – число молей вещества.
Если тело однородно, а теплоемкость считают независимой от температуры, то количество теплоты ($\Delta Q$), которое получает тело при увеличении его температуры на величину $\Delta t = t_2 — t_1$ можно вычислить как:
$$\Delta Q=c m \Delta t(3)$$где t2, t1 температуры тела до нагрева и после. Обратите внимание, что температуры при нахождении разности ($\Delta t$) в расчетах можно подставлять как в градусах Цельсия, так и в кельвинах.
Формула количества теплоты при фазовых переходах
Переход от одной фазы вещества в другую сопровождается поглощением или выделением некоторого количества теплоты, которая носит название теплоты фазового перехода.
Так, для перевода элемента вещества из состояния твердого тела в жидкость ему следует сообщить количество теплоты ($\delta Q$) равное:
$$\delta Q=\lambda d m$$где $\lambda$ – удельная теплота плавления, dm – элемент массы тела. При этом следует учесть, что тело должно иметь температуру, равную температуре плавления рассматриваемого вещества. При кристаллизации происходит выделение тепла равного (4).
Количество теплоты (теплота испарения), которое необходимо для перевода жидкости в пар можно найти как:
$$\delta Q=r d m$$где r – удельная теплота испарения. При конденсации пара теплота выделяется. Теплота испарения равна теплоте конденсации одинаковых масс вещества.
Единицы измерения количества теплоты
Основной единицей измерения количества теплоты в системе СИ является: [Q]=Дж
Внесистемная единица теплоты, которая часто встречается в технических расчетах. [Q]=кал (калория). 1 кал=4,1868 Дж.
Примеры решения задач
Пример
Задание. Какие объемы воды следует смешать, чтобы получить 200 л воды при температуре t=40С, если температура одной массы воды t1=10С, второй массы воды t2=60С?
Решение. Запишем уравнение теплового баланса в виде:
$$Q=Q_{1}+Q_{2}(1.1)$$где Q=cmt – количество теплоты приготовленной после смешивания воды; Q1=cm1t1 — количество теплоты части воды температурой t1 и массой m1; Q2=cm2t2— количество теплоты части воды температурой t2 и массой m2.
Из уравнения (1.1) следует:
$$ \begin{array}{l} \mathrm{cmt}=\mathrm{cm}_{1} t_{1}+\mathrm{~cm}_{2} t_{2} \rightarrow \mathrm{mt}=\mathrm{m}_{1} t_{1}+\mathrm{~m}_{2} t_{2} \rightarrow \\ \rightarrow \rho \mathrm{Vt}=\rho V_{1} t_{1}+\rho \mathrm{V}_{2} t_{2} \rightarrow \mathrm{Vt}=V_{1} t_{1}+V_{2} t_{2}(1.2) \end{array} $$При объединении холодной (V1) и горячей (V2) частей воды в единый объем (V) можно принять то, что:
$$$ V=V_{1}+V_{2}(1.3) $$$Так, мы получаем систему уравнений:
$$ \left\{\begin{array}{c} V t=V_{1} t_{1}+V_{2} t_{2} \\ V=V_{1}+V_{2} \end{array}\right. $$Решив ее получим:
$$ \begin{array}{l} V_{1}=\frac{\left(t_{2}-t\right)}{t_{2}-t_{1}} V \\ V_{2}=\frac{\left(t-t_{1}\right)}{t_{2}-t_{1}} V \end{array} $$Проведем вычисления (это можно сделать, не переходя в систему СИ):
$$ \begin{array}{l} V_{1}=\frac{(60-40)}{60-10} 200=80 \text { (л) } \\ V_{2}=\frac{(40-10)}{60-10} 200=120 \text { (л) } \end{array} $$Ответ.{*}\right)
\end{array}
$$ Ответ. $\Delta Q$=1700 Дж Читать дальше: Формула напряженности магнитного поля. Является частью внутренней энергии термодинамической системы в равновесии, которая пропорциональна ее абсолютной температуре и увеличивается или уменьшается за счет передачи энергии, обычно в форме тепла или работы, посредством термодинамических процессов. На микроскопическом уровне и в рамках кинетической теории это сумма средней кинетической энергии, присутствующей в результате случайных движений атомов и молекул или теплового возбуждения, которые исчезают в процессе действия. Теплопередача = масса * удельная теплоемкость * (конечная температура — начальная температура) Уравнение записано Q = m * c p (T f -T i ) У нас: Тепловая энергия Вопросы: 1) Какая энергия необходима для повышения температуры 200 граммов меди на 20 ºC, если удельная теплоемкость меди составляет 386 Дж / кгºC? Ответ: Чтобы узнать величину необходимой энергии, воспользуемся предыдущим уравнением.В этом случае у нас нет начального или конечного значения температуры для меди, поэтому разница температур составляет T f -T i = 20 ºC, m = 200 г = 0,2 кг, c p = 386 Дж / кгºC. Q = m * c p (T f -T i ) 2) Насколько поднимется температура 200 г воды, если передать энергию 2500 Джоулей? Удельная теплоемкость воды составляет 4180 Дж / кгºC. Ответ: Мы удалили разницу температур из предыдущего уравнения. Где m = 200 г = 0,2 кг, Q = 2500 Дж, c p = 4180 Дж / кгºC. Q = m * c p (T f -T i ) На предыдущей странице мы узнали, что делает тепло с объектом, когда оно накапливается или выделяется.Прирост или потеря тепла приводят к изменениям температуры, изменению состояния или выполнения работы. Тепло — это передача энергии. Когда объект приобретается или теряется, внутри этого объекта будут происходить соответствующие изменения энергии. Изменение температуры связано с изменением средней кинетической энергии частиц внутри объекта. Изменение состояния связано с изменением внутренней потенциальной энергии, которой обладает объект. А когда работа сделана, происходит полная передача энергии объекту, над которым она выполняется.В этой части Урока 2 мы исследуем вопрос Как измерить количество тепла, полученного или выделенного объектом? Предположим, что несколько объектов, состоящих из разных материалов, нагреваются одинаково. Будут ли предметы нагреваться одинаково? Ответ: скорее всего, нет. Разные материалы будут нагреваться с разной скоростью, потому что каждый материал имеет свою удельную теплоемкость.Удельная теплоемкость относится к количеству тепла, необходимому для изменения температуры единицы массы (скажем, грамма или килограмма) на 1 ° C. В учебниках часто указывается удельная теплоемкость различных материалов. Стандартные метрические единицы — Джоуль / килограмм / Кельвин (Дж / кг / К). Чаще используются единицы измерения — Дж / г / ° C. Используйте виджет ниже, чтобы просмотреть удельную теплоемкость различных материалов. Просто введите название вещества (алюминий, железо, медь, вода, метанол, дерево и т. Д.).) и нажмите кнопку «Отправить»; результаты будут отображаться в отдельном окне. Теплоемкость указана из расчета на грамм или на килограмм . Иногда значение указывается на основе на моль , и в этом случае оно называется молярной теплоемкостью. Тот факт, что они перечислены на основе на количество , является показателем того, что количество тепла, необходимое для повышения температуры вещества, зависит от того, сколько в нем вещества.Эту истину, несомненно, знает всякий, кто варил на плите кастрюлю с водой. Вода закипает при температуре 100 ° C на уровне моря и при слегка пониженной температуре на возвышенностях. Чтобы довести кастрюлю с водой до кипения, ее сначала нужно поднять до 100 ° C. Это изменение температуры достигается за счет поглощения тепла горелкой печи. Быстро замечаешь, что для того, чтобы довести до кипения полную кастрюлю с водой, требуется значительно больше времени, чем для того, чтобы довести до кипения наполовину полную. Это связано с тем, что полная кастрюля с водой должна поглощать больше тепла, чтобы вызвать такое же изменение температуры.Фактически, требуется вдвое больше тепла, чтобы вызвать такое же изменение температуры в двойной массе воды. Удельная теплоемкость также указана на основе на K или на ° C . Тот факт, что удельная теплоемкость указана из расчета на градус , указывает на то, что количество тепла, необходимое для повышения данной массы вещества до определенной температуры, зависит от изменения температуры, необходимого для достижения этой конечной температуры.Другими словами, важна не конечная температура, а общее изменение температуры. Для изменения температуры воды с 20 ° C до 100 ° C (изменение на 80 ° C) требуется больше тепла, чем для повышения температуры того же количества воды с 60 ° C до 100 ° C (изменение на 40 ° C). ° С). Фактически, для изменения температуры данной массы воды на 80 ° C требуется вдвое больше тепла по сравнению с изменением на 40 ° C. Человек, который хочет быстрее довести воду до кипения на плите, должен начать с теплой водопроводной воды вместо холодной. Это обсуждение удельной теплоемкости заслуживает одного заключительного комментария. Термин «удельная теплоемкость» в некотором роде неправильное название — . Этот термин означает, что вещества могут обладать способностью удерживать вещь , называемую теплотой. Как уже говорилось ранее, тепло — это не то, что содержится в объекте. Тепло — это то, что передается к объекту или от него. Объекты содержат энергию в самых разных формах. Когда эта энергия передается другим объектам с разной температурой, мы называем переданную энергию тепловой или тепловой энергией .Хотя это вряд ли приживется, более подходящим термином будет удельная энергоемкость. Удельная теплоемкость позволяет математически связать количество тепловой энергии, полученной (или потерянной) образцом любого вещества с массой образца и ее результирующим изменением температуры. Связь между этими четырьмя величинами часто выражается следующим уравнением. Q = m • C • ΔT где Q — количество тепла, переданного объекту или от него, m — масса объекта, C — удельная теплоемкость материала, из которого состоит объект, а ΔT — результирующее изменение температуры объекта. Как и во всех других ситуациях в науке, значение дельта (∆) для любой величины вычисляется путем вычитания начального значения количества из окончательного значения количества. В этом случае ΔT равно T final — T initial .При использовании приведенного выше уравнения значение Q может быть положительным или отрицательным. Как всегда, положительный и отрицательный результат расчета имеет физическое значение. Положительное значение Q указывает, что объект получил тепловую энергию из окружающей среды; это соответствовало бы повышению температуры и положительному значению ΔT. Отрицательное значение Q указывает на то, что объект выделяет тепловую энергию в окружающую среду; это соответствовало бы снижению температуры и отрицательному значению ΔT. Знание любых трех из этих четырех величин позволяет человеку вычислить четвертое количество. Обычная задача на многих уроках физики включает решение проблем, связанных с отношениями между этими четырьмя величинами. В качестве примеров рассмотрим две проблемы ниже. Решение каждой проблемы разработано для вас. Дополнительную практику можно найти в разделе «Проверьте свое понимание» внизу страницы. Пример задачи 1 Как и любая проблема в физике, решение начинается с определения известных величин и соотнесения их с символами, используемыми в соответствующем уравнении. В этой задаче мы знаем следующее: м = 450 г Мы хотим определить значение Q — количество тепла.Для этого мы использовали бы уравнение Q = m • C • ΔT. Буквы m и C известны; ΔT можно определить по начальной и конечной температуре. T = T окончательный — T начальный = 85 ° C — 15 ° C = 70 ° C Зная три из четырех величин соответствующего уравнения, мы можем подставить и решить для Q. Q = m • C • ΔT = (450 г) • (4,18 Дж / г / ° C) • (70 ° C) Пример задачи 2 Часть 1: Определение потерь тепла водой Дано: м = 50,0 г Решить для Q воды : Q вода = m • C • ΔT = (50,0 г) • (4,18 Дж / г / ° C) • (-1,5 ° C) Часть 2: Определите стоимость металла C Дано: Q металл = 313.5 Дж (используйте знак +, так как металл нагревается) Решить для C металл : Переставьте Q из металла = m из металла • C из металла • ΔT из металла , чтобы получить C из металла = Q из металла / (m из металла • ΔT из металла ) C металл = Q металл / (м металл • ΔT металл ) = (313.5 Дж) / [(12,9 г) • (60,6 ° C)] Приведенное выше обсуждение и соответствующее уравнение (Q = m • C • ∆T) связывает тепло, получаемое или теряемое объектом, с результирующими изменениями температуры этого объекта. Как мы узнали, иногда тепло накапливается или теряется, но температура не меняется.Это тот случай, когда вещество претерпевает изменение состояния. Итак, теперь мы должны исследовать математику, связанную с изменениями состояния и количества тепла. Чтобы начать обсуждение, давайте рассмотрим различные изменения состояния, которые можно наблюдать для образца вещества. В таблице ниже перечислены несколько изменений состояния и указаны имена, обычно связанные с каждым процессом. Процесс Изменение состояния Плавка От твердого до жидкого Замораживание От жидкости к твердому веществу Испарение От жидкости к газу Конденсация Газ — жидкость Сублимация Твердое тело в газ Депонирование Газ в твердое вещество Количество энергии, необходимое для изменения состояния образца материи, зависит от трех вещей. Это зависит от того, что это за субстанция, от того, сколько субстанции претерпевает изменение состояния, и от того, какое изменение состояния происходит. Например, для плавления льда (твердая вода) требуется другое количество энергии, чем для плавления железа. И для таяния льда (твердая вода) требуется другое количество энергии, чем для испарения того же количества жидкой воды. И, наконец, для плавления 10 требуется другое количество энергии.0 граммов льда по сравнению с таянием 100,0 граммов льда. Вещество, процесс и количество вещества — это три переменные, которые влияют на количество энергии, необходимое для того, чтобы вызвать конкретное изменение состояния. Используйте виджет ниже, чтобы исследовать влияние вещества и процесса на изменение энергии. (Обратите внимание, что теплота плавления — это изменение энергии, связанное с изменением состояния твердое-жидкое.) Для плавления и замораживания: Q = m • ΔH fusion , где Q представляет количество энергии, полученной или высвобожденной во время процесса, m представляет собой массу образца, ΔH fusion представляет собой удельную теплоту плавления (на грамм), а ΔH испарения представляет собой удельную теплоту плавления. испарение (из расчета на грамм).Подобно обсуждению Q = m • C • ΔT, значения Q могут быть как положительными, так и отрицательными. Значения Q положительны для процесса плавления и испарения; это согласуется с тем фактом, что образец вещества должен набирать энергию, чтобы плавиться или испаряться. Значения Q отрицательны для процесса замораживания и конденсации; это согласуется с тем фактом, что образец вещества должен терять энергию, чтобы замерзнуть или конденсироваться. В качестве иллюстрации того, как можно использовать эти уравнения, рассмотрим следующие два примера задач. Пример задачи 3 Уравнение, связывающее массу (48,2 грамма), теплоту плавления (333 Дж / г) и количество энергии (Q): Q = m • ΔH fusion .Подстановка известных значений в уравнение приводит к ответу. Q = м • ΔH плавление = (48,2 г) • (333 Дж / г) Пример Задачи 3 включает в себя довольно простое вычисление типа «подключай и исправляй». Теперь мы попробуем Пример задачи 4, который потребует более глубокого анализа. Пример задачи 4 В этой задаче лед тает, а жидкая вода остывает. Энергия передается от жидкости к твердому телу. Чтобы растопить твердый лед, на каждый грамм льда необходимо передать 333 Дж энергии. Эта передача энергии от жидкой воды ко льду охлаждает жидкость.Но жидкость может охладиться только до 0 ° C — точки замерзания воды. При этой температуре жидкость начнет затвердевать (замерзнуть), а лед полностью не растает. Мы знаем следующее о льду и жидкой воде: Информация о льду: м = 50,0 г Информация о жидкой воде: С = 4.18 Дж / г / ° C Энергия, полученная льдом, равна энергии, потерянной из воды. Q лед = -Q жидкая вода Знак — указывает, что один объект получает энергию, а другой объект теряет энергию. Мы можем вычислить левую часть приведенного выше уравнения следующим образом: Q лед = m • ΔH fusion = (50.0 г) • (333 Дж / г) Теперь мы можем установить правую часть уравнения равной m • C • ΔT и начать подставлять известные значения C и ΔT, чтобы найти массу жидкой воды. Решение: 16650 Дж = -Q жидкая вода На предыдущей странице Урока 2 обсуждалась кривая нагрева воды.Кривая нагрева показывала, как температура воды увеличивалась с течением времени по мере нагрева образца воды в твердом состоянии (т. Е. Льда). Мы узнали, что добавление тепла к образцу воды может вызвать либо изменение температуры, либо изменение состояния. При температуре плавления воды добавление тепла вызывает преобразование воды из твердого состояния в жидкое состояние. А при температуре кипения воды добавление тепла вызывает преобразование воды из жидкого состояния в газообразное.Эти изменения состояния произошли без каких-либо изменений температуры. Однако добавление тепла к образцу воды, не имеющей температуры фазового перехода, приведет к изменению температуры. Теперь мы можем подойти к теме кривых нагрева на более количественной основе. На диаграмме ниже представлена кривая нагрева воды. На нанесенных линиях есть пять помеченных участков. Три диагональных участка представляют собой изменения температуры пробы воды в твердом состоянии (участок 1), жидком состоянии (участок 3) и газообразном состоянии (участок 5).Две горизонтальные секции представляют изменения в состоянии воды. На участке 2 проба воды тает; твердое вещество превращается в жидкость. В секции 4 образец воды подвергается кипению; жидкость превращается в газ. Количество тепла, передаваемого воде в секциях 1, 3 и 5, связано с массой образца и изменением температуры по формуле Q = m • C • ΔT. А количество тепла, переданного воде в секциях 2 и 4, связано с массой образца и теплотой плавления и испарения по формулам Q = m • ΔH fusion (секция 2) и Q = m • ΔH испарение (раздел 4).Итак, теперь мы попытаемся вычислить количество тепла, необходимое для перевода 50,0 граммов воды из твердого состояния при -20,0 ° C в газообразное состояние при 120,0 ° C. Для расчета потребуется пять шагов — по одному шагу для каждого раздела приведенного выше графика. Хотя удельная теплоемкость вещества зависит от температуры, в наших расчетах мы будем использовать следующие значения удельной теплоемкости: Твердая вода: C = 2,00 Дж / г / ° C Наконец, мы будем использовать ранее сообщенные значения ΔH fusion (333 Дж / г) и ΔH испарения (2,23 кДж / г). Раздел 1 : Изменение температуры твердой воды (льда) с -20,0 ° C до 0,0 ° C. Использование Q 1 = m • C • ΔT , где m = 50,0 г, C = 2,00 Дж / г / ° C, T начальная = -200 ° C и T конечная = 0,0 ° C Q 1 = m • C • ΔT = (50.0 г) • (2,00 Дж / г / ° C) • (0,0 ° C — -20,0 ° C) Раздел 2 : Таяние льда при 0,0 ° C. Использование Q 2 = m • ΔH сварка , где m = 50,0 г и ΔH плавления = 333 Дж / г Q 2 = м • ΔH плавление = (50,0 г) • (333 Дж / г) Раздел 3 : Изменение температуры жидкой воды с 0,0 ° C на 100,0 ° C. Использование Q 3 = m • C • ΔT , где m = 50,0 г, C = 4,18 Дж / г / ° C, T начальная = 0,0 ° C и T конечная = 100,0 ° C Q 3 = m • C • ΔT = (50,0 г) • (4,18 Дж / г / ° C) • (100,0 ° C — 0,0 ° C) Раздел 4 : Кипячение воды при 100,0 ° C. Использование Q 4 = m • ΔH испарение , где m = 50,0 г и ΔH испарение = 2,23 кДж / г Q 4 = m • ΔH испарение = (50,0 г) • (2,23 кДж / г) Раздел 5 : Изменение температуры жидкой воды со 100.От 0 ° C до 120,0 ° C. Использование Q 5 = m • C • ΔT , где m = 50,0 г, C = 2,01 Дж / г / ° C, T начальная = 100,0 ° C и T конечная = 120,0 ° C Q 5 = m • C • ΔT = (50,0 г) • (2,01 Дж / г / ° C) • (120,0 ° C — 100,0 ° C) Общее количество тепла, необходимое для превращения твердой воды (льда) при -20 ° C в газообразную воду при 120 ° C, является суммой значений Q для каждого участка графика.То есть Q всего = Q 1 + Q 2 + Q 3 + Q 4 + Q 5 Суммирование этих пяти значений Q и округление до нужного количества значащих цифр приводит к значению 154 кДж в качестве ответа на исходный вопрос. Здесь, на этой странице, мы узнали, как рассчитать количество тепла, задействованного в любом процессе нагрева / охлаждения и в любом процессе изменения состояния.Это понимание будет иметь решающее значение, когда мы перейдем к следующей странице Урока 2, посвященной калориметрии. Калориметрия — это наука, связанная с определением изменений энергии системы путем измерения теплообмена с окружающей средой. 1. Вода имеет необычно высокую удельную теплоемкость. Какое из следующих утверждений логически следует из этого факта? а.По сравнению с другими веществами горячая вода вызывает сильные ожоги, потому что она хорошо проводит тепло. 2. Объясните, почему в больших водоемах, таких как озеро Мичиган, может быть довольно холодно в начале июля, несмотря на то, что температура наружного воздуха около или выше 90 ° F (32 ° C). 3. В таблице ниже описан термический процесс для различных объектов (выделен красным жирным шрифтом). Для каждого описания укажите, набирается или теряется тепло объектом, является ли процесс эндотермическим или экзотермическим, и является ли Q для указанного объекта положительным или отрицательным значением. Получено или потеряно тепло? Эндо- или экзотермический? Q: + или -? а. г. г. г. e. 4. Образец металлического цинка массой 11,98 грамма помещают в баню с горячей водой и нагревают до 78,4 ° C. Затем его удаляют и помещают в чашку из пенополистирола, содержащую 50,0 мл воды комнатной температуры (T = 27,0 ° C; плотность = 1,00 г / мл). Вода прогревается до температуры 28.1 ° С. Определите удельную теплоемкость цинка. 5. Джейк берет из туалета банку с газировкой и выливает ее в чашку со льдом. Определите количество тепла, теряемого содой комнатной температуры при плавлении 61,9 г льда (ΔH fusion = 333 Дж / г). 6. Теплота сублимации (ΔH сублимации ) сухого льда (твердый диоксид углерода) составляет 570 Дж / г. Определите количество тепла, необходимое для превращения 5,0-фунтового мешка сухого льда в газообразный диоксид углерода.(Дано: 1,00 кг = 2,20 фунта) 7. Определите количество тепла, необходимое для повышения температуры 3,82-граммового образца твердого пара-дихлорбензола с 24 ° C до жидкого состояния при 75 ° C. Пара-дихлорбензол имеет температуру плавления 54 ° C, теплоту плавления 124 Дж / г и удельную теплоемкость 1,01 Дж / г / ° C (твердое состояние) и 1,19 Дж / г / ° C (жидкое состояние). Статистические методы становятся более точным способом изучения природы при большом количестве частиц.Таким образом, мы ожидаем, что описание скоростей молекул в газе на самом деле будет наиболее вероятным распределением, поскольку мы имеем дело с числами частиц в диапазоне числа Авогадро. Но это наиболее вероятное распределение (распределение Максвелла-Больцмана) подлежит ограничениям, а именно, что количество частиц постоянно и что полная энергия постоянна (закон сохранения энергии). Максимизация вероятностного распределения с учетом этих ограничений в целом является сложной математической задачей (см. Richtmyer, et al., Например). Один из способов подойти к решению более интуитивно — это рассмотреть известный нам физический пример, а именно физику атмосферы под действием силы тяжести, отраженную в барометрической формуле. Следующее лечение следует за разработкой Rohlf. В этом подходе мы используем тот факт, что средняя кинетическая энергия молекул может быть выражена через кинетическую температуру. Кроме того, мы знаем, что сохранение энергии в этом случае включает просто баланс кинетической энергии и гравитационной потенциальной энергии, если мы рассматриваем атмосферу как идеальный газ. Из выражения для кинетической температуры у нас есть описание идеальной газовой системы, которое можно использовать, чтобы помочь разработать аргумент правдоподобия для распределения Максвелла по скоростям. Шаги в этом процессе следующие: Для одного направления в пространстве этот процесс дает выражение: , а когда включены все направления скорости, получается соотношение распределения скоростей Максвелла: Следует отметить, что хотя мы использовали физическую ситуацию, зависящую от гравитации, для получения распределения скоростей, гравитация не появляется в конечном результате.То есть полученный результат является общим, не содержащим g. Барометрическая формула использовалась просто как конструкция, чтобы связать распределение скоростей с ограничениями по энергии и количеству частиц. Наш калькулятор тепловой энергии представляет собой удобный инструмент, который может характеризовать параметры идеального газа, такие как средняя кинетическая энергия молекул, средняя скорость молекул или общая тепловая энергия газа. Поведение газов можно объяснить кинетической молекулярной теорией, которая описывает газ как большое количество атомов или молекул, находящихся в постоянном движении.Эти частицы могут сталкиваться друг с другом и со стенками контейнера. Прочтите, если вы хотите узнать больше об определении кинетической молекулярной теории и узнать, какова взаимосвязь между температурой и кинетической энергией. В тексте ниже мы объяснили, что такое тепловая энергия, а также предоставили определение тепловой энергии и уравнение тепловой энергии. Вас также может заинтересовать наш калькулятор атмосферного давления на высоте или калькулятор плотности воздуха. Кинетическая молекулярная теория утверждает, что давление газа вызывается ударами молекул о стенки контейнера.Эти молекулы сталкиваются друг с другом, изменяя таким образом свои скорости. Определение кинетической молекулярной теории сформулировано при определенных предположениях: Эти предположения приблизительно выполняются для газов при не слишком высоких давлениях и не слишком низких температурах. Тепловая энергия — это внутренняя кинетическая энергия, возникающая из-за беспорядочного движения молекул. Каждая молекула имеет разную скорость (которая меняется после столкновений), которую можно описать распределением Максвелла-Больцмана.Мы написали об этом больше в нашем калькуляторе скорости частиц, где вы также можете вычислить среднюю скорость частиц при определенной температуре. Полная тепловая энергия газа определяется суммой кинетических энергий всех частиц. Вы должны помнить, что приравнивать тепловую энергию к теплу — ошибка. Тепло, как и работа, — это способ передачи энергии. И если мы хотим ответить на вопрос, что такое тепловая энергия, мы можем сказать, что это внутреннее свойство системы. Какова связь между температурой и кинетической энергией в идеальном газе? Вы можете найти ответ на этот вопрос с помощью нашего калькулятора тепловой энергии, который может вычислить среднюю кинетическую энергию частиц, среднюю скорость частиц и общую тепловую энергию газа. Он использует следующие формулы: где Число степеней свободы — это физический параметр, который необходим для характеристики состояния физической системы. В нашем калькуляторе тепловой энергии мы приняли, что она равна Хотите оценить другие параметры идеального газа? Воспользуйтесь нашим калькулятором закона идеального газа, чтобы узнать, какова связь между температурой, давлением и объемом газа. Обновлено 28 декабря 2020 г. Автор: Кевин Бек Тепловая энергия, также называемая тепловой энергией или просто тепловой , это тип внутренней энергии , которой объект обладает благодаря кинетической энергии составляющих его частиц. Сама энергия, хотя ее достаточно легко определить в математических терминах, является одной из наиболее неуловимых величин в физике с точки зрения того, что по сути является .Есть много форм энергии, и легче определить энергию в терминах пределов ее арифметического поведения, чем сформулировать ее точным языком. В отличие от поступательного или вращения кинетической энергии, которые возникают в результате движения на некотором линейном расстоянии или по кругу, соответственно (и они могут происходить вместе, как в случае брошенного фрисби), тепловая энергия исходит от движение огромного количества крошечных частиц, движение, которое можно представить как вибрацию вокруг фиксированных точек в пространстве. В среднем каждая частица находится в определенном месте внутри расширенной системы, поскольку она отчаянно блуждает вокруг этой точки, даже если ни в какой момент времени частица статистически не может быть там обнаружена. Это скорее похоже на среднее положение Земли с течением времени, близкое к центру Солнца, хотя такое расположение (к счастью!) Никогда не происходит. Каждый раз, когда два материала вступают в контакт, включая воздух, происходит трение , и некоторая часть полной энергии системы, которая, как вы увидите, всегда должна оставаться постоянной, преобразуется в тепловую энергию. Объект и его окружение испытывают повышение температуры , что является количественным выражением тепловой энергии и теплопередачи , измеряемых в градусах Цельсия (° C), градусах Фаренгейта (° F) или Кельвинах. (К). Когда предметы теряют тепло, они опускаются до более низкой температуры. Энергия бывает разных форм, а также различных единиц, наиболее распространенной из которых является джоуль (Дж) , названная в честь Джеймса Прескотта Джоуля.Сам джоуль состоит из единиц силы, умноженной на расстояние, или ньютон-метров (Н · м). Более фундаментально, единицы энергии — кг⋅м 2 / с 2 . Одно понятие, тесно связанное с энергией, — это работа , которая имеет единицы энергии , но не рассматривается физиками как как энергия . Можно сказать, что работа «выполняется» в системе путем добавления к ней энергии, что приводит к физическим изменениям в системе (например, она перемещает поршень или вращает магнитную катушку, то есть выполняет полезную работу. ).Система — это любое физическое устройство с четко определенными границами, которым может быть даже Земля в целом. В дополнение к тепловой энергии (обычно обозначаемой Q) и кинетической энергии («нормальный» линейный или вращательный вид), другие типы энергии включают потенциальную энергию , механическую энергию и электрическую энергию . Критическим аспектом энергии является то, что, независимо от того, как она проявляется в любой системе, всегда сохраняется . Когда происходит передача тепловой энергии в окружающую среду (т.е.е., она «рассеивается» или «теряется»), конечно, на самом деле энергия никоим образом не разрушается, так как это нарушило бы закон сохранения энергии. Однако это тепло не может быть полностью уловлено и повторно использовано, поэтому его называют менее полезной формой энергии. Когда зимой вы проезжаете мимо здания или наземного вентиляционного отверстия, и из него выходит бесконечное облако пара или теплого воздуха, это наглядный пример тепловой энергии, которая является «бесполезной» энергией. С другой стороны, тепловая машина , подобная той, что используется в автомобилях с бензиновым двигателем, использует тепловую энергию для получения механической энергии. Температура объекта или системы является мерой средней кинетической энергии поступательного движения на молекулу этого объекта, а тепловая энергия — это полная внутренняя энергия системы. Когда частицы движутся, всегда есть кинетическая энергия. Перемещение тепла вверх против температурного градиента требует работы, например использования тепловых насосов. Тепловая энергия может фигурировать здесь как ненормальная величина, но она может быть отлично использована в кулинарии и других сферах.Когда вы перевариваете пищу, вы превращаете химическую энергию из связей в углеводах, белках и жирах в тепло («калории» вместо джоулей в обычном понимании). Трение выделяет тепло, часто в спешке. Если быстро потереть руки, они быстро нагреются. Автоматическое оружие выпускает пули из ствола так быстро, что металл почти сразу становится опасно горячим на ощупь. Рассмотрим шарик, катящийся внутри чаши.«Система» также включает в себя окружающую среду (то есть Землю в целом). По мере того, как он движется вверх, большая часть его полной энергии преобразуется в гравитационную потенциальную энергию; по мере того, как он ускоряется у дна, большая часть этой энергии преобразуется в кинетическую энергию. Если бы это была вся история, шарик продолжал бы подниматься и опускаться бесконечно, достигая одинаковой высоты и скорости с каждым циклом. Вместо этого каждый раз, когда шарик поднимается на борт, он поднимается немного ниже и его скорость внизу немного меньше, пока, в конце концов, шарик не останавливается внизу.Это связано с тем, что все время, пока шарик катился, все больше и больше «пирога» полной энергии преобразовывалось во все больший и больший «кусок» тепловой энергии и рассеивалось в окружающей среде, больше не пригодное для использования мрамором. Внизу вся энергия системы «стала» тепловой энергией. Одно из уравнений, с которыми вы можете столкнуться, это уравнение для теплоемкости : Q = mC \ Delta T , где Q — тепловая энергия в джоулей, м, — масса нагреваемого объекта, C, — удельная теплоемкость объекта, , , емкость , и дельта T, — это изменение температуры в градусах Цельсия.Удельная теплоемкость вещества — это количество энергии, необходимое для повышения температуры 1 грамма этого вещества на 1 градус Цельсия . Таким образом, более высокая теплоемкость означает большее сопротивление изменению температуры для данной массы вещества, а большая масса сама по себе означает более высокую теплоемкость. Это имеет интуитивный смысл; Если вы подвергали 10 мл воды воздействию «высокой температуры» в микроволновой печи в течение одной минуты, изменение температуры будет намного больше, чем если бы вы нагревали 1000 мл воды, начиная с той же температуры, в течение того же периода времени. Термодинамика — это исследование того, как работа, тепло и внутренняя энергия взаимодействуют в системе. Важно отметить, что это касается только крупномасштабных наблюдений, которые можно измерить; кинетическая теория газов рассматривает взаимодействия на колебательном уровне. Первый закон термодинамики гласит, что изменения внутренней энергии можно объяснить тепловыми потерями: ΔE = Q — W, где ΔE — изменение внутренней энергии (Δ — греческая буква «дельта»). , «и здесь означает» различие «), Q — это количество тепловой энергии, переданное в систему и Вт, — это работа, выполненная системой в окружающей среде. Второй закон термодинамики гласит, что всякий раз, когда выполняется работа, количество энтропии в атмосфере увеличивается. Таким образом, поток тепловой энергии постоянно увеличивает энтропию. \ Delta S = \ frac {\ Delta Q} {T} Третий закон термодинамики гласит, что энтропия S системы приближается к постоянному значению, когда температура T приближается к абсолютному нулю (0 K или -273 С). Когда один объект имеет более высокую температуру, чем соседний объект, эта разница температур способствует передаче энергии в виде тепла более холодному объекту. Существует три основных способа передачи тепла от одного объекта к другому: теплопроводность (прямой контакт), конвекция (движение через жидкость или газ) и тепловое излучение (движение в пространстве). Имея термометр — способ измерения того, насколько что-то горячее или холодное — мы можем начать серию экспериментов, чтобы наблюдать, как объекты разделяют свою тепловую энергию, когда они собраны вместе.Вот пример: Результатом являются три важных наблюдения: Чтобы понять, что делать в общем случае, давайте построим механистическую модель того, что происходит, когда два объекта в хорошем контакте достигают одинаковой температуры. Чтобы увидеть, что происходит, когда два объекта, находящиеся в хорошем контакте, достигают одинаковой температуры, давайте создадим модель, основанную на нашем понимании того, что происходит. Вот основные идеи модели: Тепловая энергия, передаваемая от одного объекта к другому при контакте, обозначается как тепло и обычно обозначается символом Q . Если мы предположим, что количество тепловой энергии в объекте пропорционально температуре, умноженной на массу (не совсем верно, но нормально, если мы смотрим на небольшие изменения), то в результате этих экспериментов мы бы предположили: $$ \ Delta T = \ frac {Q} {mc} $$ Изменение температуры, вызванное количеством тепловой энергии Q , входящей в массу м является результатом распределения этой тепловой энергии по каждой части массы и должно корректироваться постоянной, c , которая зависит от того, что это за вещество.Константа c называется удельной теплоемкостью конкретного материала. Хотя это способ смотреть на уравнение, которое гласит, что «передача тепловой энергии вызывает изменение температуры», уравнение обычно записывается так: $$ Q = mc \ Delta T $$ Обратите внимание, что то, что мы делаем, аналогично тому, что мы делаем в ряде ситуаций, когда мы пытаемся извлечь свойства, которые зависят от внешних обстоятельств и конкретных объектов, из свойства материи, которое зависит только от того, что это за субстанция.Мы сделали это, когда, например, определили плотность, модуль Юнга и объемный модуль. Теперь можно легко понять, что происходит, когда мы соединяем две субстанции. Предположим, что у нас есть одно и то же вещество масс m 1 и m 2 при температурах $ T_1 $ и $ T_2 $ соответственно, и они достигают конечной температуры $ T $. Для конкретности предположим, что 1 горячее, 2 холоднее и оба являются водой.Тогда тепло, поступающее в холодную воду (2), является положительной величиной, а тепло, поступающее в горячую воду (1), является отрицательной величиной (то есть она уходит, а не входит). Изменение температуры холодной воды положительное, а горячей — отрицательное. Уравнение теплового потока говорит нам $$ Q_ {1 \ rightarrow 2} = -Q_ {2 \ rightarrow 1} $$ $$ m_1c_1 (T — T_1) = -m_2c_2 (T — T_2) $$ Проверьте, почему мы ставим знаки именно так! Теперь, поскольку оба объекта являются водой, объекты c одинаковы и взаимно компенсируются.Теперь мы можем решить для T : $$ m_1 (T — T_1) = -m_2 (T — T_2) $$ $$ m_1T — m_1T_1 = -m_2T + m_2T_2 $$ $$ m_1T + m_2T = m_1T_1 + m_2T_2 $$ $$ (m_1 + m_2) T = m_1T_1 + m_2T_2 $$ $$ T = \ bigg (\ frac {m_1} {m_1 + m_2} \ bigg) T_1 + \ bigg (\ frac {m_2} {m_1 + m_2} \ bigg) T_2 $$ Именно такой результат мы нашли экспериментально! Конечные температуры — это исходные температуры, взвешенные по доле общей массы, которую они представляют. Если мы включим удельные плавки как возможные разные, то получится $$ T = \ bigg (\ frac {m_1c_1} {m_1c_1 + m_2c_2} \ bigg) T_1 + \ bigg (\ frac {m_2c_2} {m_1c_1 + m_2c_2} \ bigg) T_2 $$ Конечная температура — это исходная температура, взвешенная как доля от общего значения « mc », которое они представляют. Эта комбинация — масса, умноженная на удельную теплоемкость — называется теплоемкостью объекта . Хотя это может показаться не так из запутанной алгебры, приведенной выше, в конкретных примерах намного проще сохранять знаки прямо, если вы НЕ пытаетесь запомнить приведенное выше уравнение, а вместо этого используете концептуальное уравнение о том, как поток энергии связан с изменением температуры. ($ Q = mcΔT $) и работаем над этим. Когда этот материал был впервые изучен в начале 1800-х годов, связь с движением молекул и механической энергией не была понята. В результате «что бы это ни было», которое передавалось от одного объекта к другому при изменении температуры, получило собственное определение и определило его собственный стандарт. Количество «тепла», которое необходимо передать, чтобы изменить температуру 1 грамма воды на 1 ° C, было принято равным на 1 калорию .(На самом деле, это было указано, когда температура воды была 4 ° C, поскольку удельная теплоемкость воды немного меняется в зависимости от температуры. Мы проигнорируем это.) Это приводит к тому, что количество «тепла», которое необходимо передать для изменения температуры 1 кг воды на 1 ° C равняется 1000 калорий. Это иногда называют килокалорий, или просто «большой» калорийностью (калория с большой буквы). Это очень сбивает с толку. Намного лучше перейти к стандартной единице Джоуля для энергии. Преобразование 1 кал = 4.186 Джоулей 1 ккал = 4186 Дж Хотя это устанавливает основную концепцию температуры и ее связи с энергией, ситуация более сложная. Часто требуется тепловая энергия, чтобы изменить состояние вещества — расположение и, следовательно, потенциальную энергию, связанную с его молекулярными взаимодействиями. Таким образом, для плавления льда или превращения воды в пар требуется тепловая энергия — без изменения температуры. Кроме того, наше понимание значения температуры развивается по мере того, как мы понимаем, как она связана с движением молекул.Эти и другие вопросы обсуждаются ниже. Джо Редиш 19.11.11, 30.11.12 В предыдущем разделе мы смоделировали макроскопическое определение энергии связи из главы 1 с микроскопической точки зрения нейтральных субатомных частиц, взаимодействующих с парным потенциалом. В этом разделе мы попытаемся сделать такое же подключение для тепловой энергии. В главе 1 для чистых веществ в диапазоне температур, в котором применима трехфазная модель, мы сказали, что полная энергия системы определяется выражением: \ [E_ {tot} = E_b + E_ {th} \ label {Etot1} \] В микроскопическом описании частиц, взаимодействующих с потенциалом Леннарда-Джонса, полная энергия системы равна: \ [E_ {tot} = PE_ {tot} + KE_ {tot} \ label {Etot2} \] Нижний индекс «tot» относится к сумме кинетической и потенциальной энергий всех частиц.Хотя пока мы сосредоточимся только на двух частицах, для общности мы добавляем индекс «tot», чтобы уравнения можно было применять и к системам с множеством частиц. В предыдущем разделе мы сказали, что макроскопическая энергия связи может быть смоделирована как сумма парных потенциальных энергий между всеми парами в их равновесных конфигурациях (при нулевой температуре). Ваш инстинкт может сказать вам, что тепловая энергия должна быть представлена в виде суммы всех кинетических энергий частиц.Но осторожно! Если мы добавим немного энергии к двухчастичной системе, не разрывая связи, энергия связи не изменится, поэтому изменится только тепловая энергия. И, как мы обсуждали в разделе 3.2, когда к системе добавляется энергия, частицы начинают колебаться около равновесия. Поскольку энергия добавляется к системе, увеличивая только тепловую энергию, диапазон колебаний увеличивается, что увеличивает как среднюю потенциальную, так и кинетическую энергию, как можно увидеть на рисунке ниже. Рисунок 3.5.1: Полная энергия в двухчастичной системе. Таким образом, тепловая энергия связана с потенциальной энергией, а также с кинетической. При добавлении энергии невозможно увеличить кинетическую энергию без увеличения потенциальной энергии. Как и в системе пружина-масса, когда вы добавляете потенциальную энергию, растягивая пружину дальше, вы также увеличиваете кинетическую энергию, поскольку пружина будет колебаться в среднем быстрее. В разделе 2.6 мы обсуждали, что усредненные по времени кинетическая и потенциальная энергии для системы пружина-масса одинаковы и, как результат, половина полной энергии.Поскольку потенциал Леннарда-Джонса имитирует потенциал пружинной массы, по крайней мере, для небольших колебаний, мы будем предполагать, что это взаимодействие при усреднении по времени также приведет к \ (KE_ {avg} = PE_ {avg} \). Когда энергия добавляется без разрыва связей, вся энергия переходит в тепловую, которая поровну распределяется между кинетической и потенциальной энергией: \ [KE_ {tot} = \ frac {E_ {th}} {2} \] Потенциальная энергия, составляющая вторую половину тепловой энергии, связана со случайными колебаниями, но есть также часть потенциальной энергии, которая равна энергии связи при нулевой температуре до добавления энергии: \ [PE_ {tot} = \ frac {E_ {th}} {2} + E_b \] Чтобы проверить справедливость этих уравнений, сложите их вместе, чтобы получить: \ [KE_ {tot} + PE_ {tot} = E_ {th} + E_b \] , что в точности соответствует двум определениям полной энергии, данным в уравнениях \ ref {Etot1} и \ ref {Etot2}, устанавливая связь между микроскопическим и макроскопическим описаниями полной энергии. Здесь мы видели, что по мере увеличения тепловой энергии частицы начинают колебаться относительно своего равновесия. Таким образом, тепловая энергия связана со случайными колебаниями частиц, а энергия связи связана с их равновесными конфигурациями. Мы также обсудили идею равномерного распределения добавленной энергии между кинетической и потенциальной энергиями, что приведет нас к идее равного распределения энергии , приведенной ниже. В модели тепловой энергии частиц мы описываем тепловую энергию макроскопического твердого тела жидкости в терминах случайных флуктуаций субатомных частиц, которые колеблются в трех пространственных измерениях.Поскольку большинство колеблющихся систем можно описать пружинным потенциалом, мы будем моделировать эти колеблющиеся частицы как массы, удерживаемые на месте тремя перпендикулярными пружинами, по одной для каждого независимого пространственного измерения, как показано на рисунке ниже. Рисунок 3.5.1: Модель тепловой энергии с частицами, прикрепленными к пружинам. Чтобы понять, как тепловая энергия может быть получена из этих случайных флуктуаций, мы хотели бы знать, сколькими способами каждая из этих частиц может «иметь энергию» и как общая энергия распределяется между этими различными «способами»? Чтобы ответить на этот вопрос в рамках ограничений нашей модели, мы начнем с того факта, что система пружина-масса имеет кинетическую и потенциальную энергию.Из-за случайности или беспорядка тепловых движений микроскопических пружинных масс во всех трех пространственных направлениях вполне вероятно, что в среднем каждая пружина будет иметь такие же средние значения KE и PE, как и любая другая пружина. Потенциальную и кинетическую энергии, которые связаны с этими колебаниями, можно каждый, разделить на три независимых члена, каждый из которых соответствует одному из трех независимых пространственных измерений. Следовательно, каждая частица в жидкости или твердом теле имеет , по крайней мере, , эти шесть, независимых способов, которыми она может «обладать энергией». Здесь важно помнить, что независимо от фактического вида химической связи (типы связей и геометрическая конфигурация связей) тепловая энергия, возникающая из-за колебаний атомов или молекул (рассматриваемых как твердые частицы), моделируется. как будто они связаны тремя независимыми пружинами, соответствующими трем независимым пространственным измерениям в трехмерной вселенной. У несвязанных атомов в газовой фазе есть другие способы получения энергии, они могут свободно перемещаться в пространстве.Если газ состоит из молекул, отдельные молекулы также могут вращаться и колебаться. Существует название или ярлык для «способа получения энергии», который мы называем режимом , также иногда называемым степенью свободы . Когда мы обсуждали двухчастичную систему, мы утверждали, что разумно предположить, что половина тепловой энергии идет на кинетическую, а другая половина — на потенциальную при усреднении по времени. С точки зрения модели частиц, когда макроскопическая система достигает теплового равновесия, энергия, связанная со случайными флуктуациями (движения частиц относительно их положений равновесия в твердом или жидком теле или их случайные движения в газовой фазе) составляет , равномерно распределенная по всей образца . То есть будет примерно столько же энергии, связанной со случайными энергиями маленького кусочка образца, как и с любым другим маленьким кусочком того же размера. Это известно как Равнораспределение энергии . Это похоже на то, что мы сказали бы о температуре, если мы подождем достаточно долгое время, температура станет однородной по всему образцу. Казалось бы, существует прямая связь между температурой и беспорядочным случайным движением, связанным с тепловой энергией.{-23} Дж / К \) — постоянная Больцмана , и T, — температура. Это выражение обеспечивает связь между макроскопической концепцией температуры и микроскопической идеей моды . На словах приведенное выше уравнение означает, что температура является мерой средней энергии в активном режиме, когда образец находится в тепловом равновесии. Чтобы вычислить полную тепловую энергию, нам нужно умножить коэффициент \ (\ frac {1} {2} k_BT \) для тепловой энергии для каждой моды на общее количество мод в нашем образце.Общее количество мод равно общему количеству частиц в N, умноженному на количество мод на частицу. Таким образом, общую тепловую энергию можно записать как: \ [E _ {\ text {Thermal}} = \ text {(# режимов на частицу)} \ times N \ times \ frac {1} {2} k_ {B} T \] Наша следующая задача — подсчитать количество мод на частицу для разных типов веществ. Когда мы спросили, сколько способов каждая пружина в твердом теле может иметь энергию, ответ был двумя: кинетическим и потенциальным.Мы будем называть эти моды колебательной кинетической энергией , KE vib и колебательной потенциальной энергией , PE vib модами. Чтобы ответить на вопрос, сколькими способами каждая частица в твердом теле должна обладать энергией, мы увидели, что существует три пружины и две моды на пружину, поэтому твердое тело должно иметь шесть режимов: 3 KE vib мод и 3 PE виб . Равнораспределение энергии говорит нам, что каждая из этих мод будет иметь одинаковое количество энергии \ (\ frac {1} {2} k_BT \) при тепловом равновесии.Один моль твердого тела будет иметь \ (6N_A \) количество мод, в результате чего общая тепловая энергия составит: \ [E _ {\ text {Thermal}} = 3N_Ak_ {B} T \] Сколько режимов у разных газов? В простом одноатомном газе , состоящем из отдельных атомов, таких как газы He или Ne, или Благородные газы, атомы больше не взаимодействуют с парным потенциалом, поскольку их среднее расстояние между ними составляет \ (r \ sim 10 \ сигма \). Следовательно, атомы нельзя моделировать с помощью пружин, поскольку они не колеблются вокруг некоторого равновесия.2 = \ frac {3} {2} k_BT \] В двухатомном газе , состоящем из двухатомных молекул, таких как H 2 или O 2 , все еще нет межмолекулярных (между молекулами) взаимодействий, но теперь существует внутримолекулярных (между атомами в молекуле) взаимодействия, которые необходимо учитывать. Мы можем смоделировать связь между двумя атомами в молекуле как пружину, позволяющую двум атомам колебаться относительно друг друга. Таким образом, каждая молекула будет иметь один колебательный режим кинетической и потенциальной энергии.Кроме того, что касается одноатомного газа, молекула в целом может свободно перемещаться в пространстве, поскольку она не взаимодействует с другими молекулами. Таким образом, каждая молекула имеет 3 режима поступательной кинетической энергии. Другой способ получения этой молекулы кинетической энергии — вращение. На рисунке ниже показаны все возможные вращательные моды двухатомной молекулы. Энергия, связанная с вращением, известна как кинетическая энергия вращения , KE rot . Для двухатомной молекулы энергетически разрешены только две моды вращения (по причинам квантовой механики мы не будем здесь останавливаться).Как показано на рисунке, это вращения вокруг осей y и z. Один из способов подумать об этом состоит в том, что энергетически разрешены только вращения, которые изменяют ориентацию молекулы или не являются симметричными. Таким образом, поскольку вращение молекулы вокруг оси x симметрично, такое вращение недопустимо. Для двухатомного газа мы нашли всего 7 режимов: 3 KEtrans , 2 KE rot , 1 KEvib и 1 P Evib . Рисунок 3.5.2: Режимы двухатомной молекулы. Обычно многоатомный газ состоит из молекул с числом атомов N . Молекула является линейной , когда все атомы расположены по прямой линии, как и все двухатомные молекулы. Другими примерами линейных молекул являются CO 2 и C 2 H 2 . Все линейные молекулы имеют 3 KE trans мод и 2 KE rot . Нелинейные молекулы , такие как H 2 O, несимметричны, могут вращаться вокруг всех трех осей, таким образом, имеют 3 моды KE rot . Непосредственный подсчет количества форм колебаний может оказаться сложной задачей. Ниже представлены все возможные колебательные моды в нелинейной трехатомной молекуле . Рисунок 3.5.3: Возможные колебательные моды в нелинейной трехатомной молекуле. Однако, не задумываясь о геометрии всех возможных колебаний, мы можем косвенно подсчитать количество мод колебаний.Если рассматривать каждый атом в многоатомной молекуле независимо, мы заключаем, что молекула имеет 3N мод кинетической энергии, по 3 для каждого атома. Мы знаем, что нелинейная молекула будет иметь 3 KE trans и 3 KErot . Чтобы добавить до 3N мод полной кинетической энергии , \ (3N = 3 + 3 + (KE_ {vib}) \), мы находим, что должно быть ( 3N-6) KE vib мод. Для каждой кинетической колебательной моды должна существовать потенциальная колебательная мода, поэтому также существуют моды 3N-6 P E vib .Таким образом, общее количество возможных мод в нелинейной многоатомной молекуле составляет: \ [\ textrm {общее количество режимов} = 3 (KE_ {trans}) + 3 (KE_ {rot}) + (3N-6) (KE_ {vib}) + (3N-6) (PE_ {vib} ) = 6Н-6 \] Аналогичный анализ можно провести для нелинейных молекул. Сводное количество режимов для всех типов веществ показано в таблице ниже. Таблица 3.5.1: Количество режимов для различных веществ в 3D. Цельный 0 0 6 6 Линейный многоатомный газ (N атомов) 3 2 6Н-10 6Н-5 Нелинейный многоатомный газ (N атомов) 3 6Н-12 6Н-6 Иногда, однако, некоторые моды не «возбуждаются» из-за квантования уровней энергии.При низких температурах квантовое расщепление между уровнями энергии больше, чем тепловая энергия, и режим не может быть активирован. Когда это происходит, мы говорим, что режим заморожен . Замороженные режимы не может распределять тепловую энергию между другими режимами. Активные режимы — единственные, которые поровну делят тепловую энергию между собой. Вращательные моды обычно имеют меньшую энергию, чем колебательные. Таким образом, колебательные моды заморожены для типичных температур, но вращательные моды также могут стать неактивными, когда температура достаточно низкая.Трансляционные режимы всегда активны, пока температура выше нуля Кельвина. Пример \ (\ PageIndex {1} \) 1) Вы проводите различные эксперименты по определению свойств неизвестного вещества. В одном эксперименте вы помещаете 10 молей твердого вещества и 12 молей неизвестного вещества в отдельные изолированные и герметичные контейнеры. Вы обнаружите, что когда вы добавляете одинаковое количество энергии к каждому контейнеру, вы измеряете одно и то же изменение температуры. Предположим, что для любого вещества нет фазовых изменений.Определите, является ли неизвестное вещество твердым, одноатомным газом, двухатомным газом с замороженными колебательными модами или диамотическим газом с активными колебательными модами. 2) В другом эксперименте вы объединяете 2 моля твердого вещества с 3 молями двухатомного газа с колебательными модами, замороженными в изолированном контейнере. Два вещества изначально находятся при разных температурах. Когда два вещества достигают теплового равновесия, какое из них будет иметь большее изменение температуры? 1) В модели тепловой энергии частиц изменение тепловой энергии дается как: \ [\ Delta E _ {\ text {Thermal}} = \ text {(# режимов на частицу)} \ times N \ times \ frac {1} {2} k_ {B} \ Delta T \ nonumber \] Поскольку \ (\ Delta E _ {\ text {Therm}} \) одинаково для одного и того же ΔT для обоих веществ, общее количество режимов должно быть одинаковым для обоих веществ.Общее количество мод — это количество частиц, умноженное на количество мод на частицу, поэтому для твердого тела мы получаем: \ [\ text {total # mode} = 10N_A \ times 6 = 60N_A \ nonumber \] Для неизвестного вещества: \ [\ text {total # mode} = 60N_A = 12N_A \ text {(# режимов на частицу)} \ nonumber \] , что дает (# мод на частицу) = 5, что верно для двухатомного газа с замороженными колебательными модами. 2) Поскольку два вещества представляют собой замкнутую систему, \ (\ Delta E _ {\ text {therm}} \), полученное одним веществом, должно быть равно \ (\ Delta E _ {\ text {Thermal}} \) потерянным. по другому: \ [\ text {(всего # режимов твердого тела)} | \ Delta T_ {solid} | = \ text {(всего # режимов газа)} | \ Delta T_ {gas} | \ nonumber \] Из приведенного выше уравнения видно, что вещество с меньшим общим количеством режимов будет иметь большее изменение температуры. Твердое тело имеет общее количество мод \ (2N_A \ times 6 = 12N_A \), а двухатомный газ с вымороженными колебательными модами имеет общее количество мод \ (3N_A \ times 5 = 15N_A \) . Таким образом, твердое тело будет иметь большее изменение температуры. Давайте теперь свяжем определение макроскопической тепловой энергии из главы 1 и микроскопическое описание, представленное здесь. В частности, мы хотели бы развить понимание теплоемкости из главы 1 с точки зрения микроскопических параметров. Но нам нужно быть осторожными, чтобы на самом деле сравнивать одни и те же вещи.Мы знаем, что если сила действует на расстоянии, один физический объект будет воздействовать на другой. Когда мы проводим измерение теплоемкости, мы не хотим, чтобы образец работал с атмосферой или контейнером, в котором он находится. Поэтому мы указываем, что образец должен сохраняться в постоянном объеме во время измерения теплоемкости. Важным моментом здесь является то, что у нас есть способ напрямую измерить изменение тепловой энергии путем измерения теплоемкости образца при постоянном объеме, гарантируя, что все тепло, которое мы вкладываем в образец, идет на изменение его тепловой энергии, а не на некоторое работайте, расширяя емкость или давя на воздух в комнате.Из модели энергетического взаимодействия, когда работа не выполняется и изменяется только температура, мы имеем \ (\ Delta E_ {tot} = \ Delta E_ {th} = Q \). Когда изменение тепловой энергии происходит исключительно за счет добавления или отвода энергии в виде тепла, теплоемкость постоянного объема, обозначенная индексом «v», C V , определяется скоростью изменения тепловой энергии с относительно температуры. Именно так мы определили тепловую энергию в уравнении 1.2.6 в главе 1: \ [\ Delta E_ {термический} = C_V \ Delta T \] , за исключением того, что теперь мы добавляем индекс «V» для точности.Вышеприведенное выражение является макроскопическим определением тепловой энергии при постоянном объеме. Давайте сравним приведенное выше уравнение с уравнением 3.4.7, описанным в модели тепловой энергии частиц. Приравнивая два уравнения друг к другу, используя газовую постоянную \ (R = N_Ak_B = 8.314 \ frac {J} {Kmol} \) и решая молярную теплоемкость \ (c_ {v, mol} \) (\ ( C_V = c_ {v, mol} \) на один моль или N A количество частиц), получаем: \ [c_ {v, mol} = \ frac {R} {2} \ text {(# режимов на частицу)} \ label {Cv} \] У нас есть простое выражение выше, которое связывает идею теплоемкости, которая может быть экспериментально измерена в лаборатории с использованием макроскопических веществ, с микроскопической идеей каждой частицы в веществе, имеющей энергетический режим.Далее мы проверим правильность этой модели, когда рассмотрим некоторые шаблоны данных. Пример \ (\ PageIndex {1} \) Ученые Калифорнийского университета в Дэвисе конструируют следующую одномерную твердую структуру из своих недавно обнаруженных атомов, Aggieum ( Ai ) и Cyclerium ( Cy ): Общее количество атомов 4N A . Двойные линии представляют собой сильные связи Ai-Cy, а одиночные линии — более слабые связи AiCy-AiCy.Каждая частица может двигаться только в одном измерении. a) Вычислите теплоемкость C v для вещества на диаграмме. б) Вы добавляете достаточно энергии, чтобы разорвать все более слабые связи. Образующиеся частицы газа могут свободно перемещаться в трех измерениях. Рассчитайте теплоемкость C v для этого вещества, предполагая, что все режимы активны. c) Вы добавляете еще немного энергии и замечаете, что при T = 500K все более прочные связи также разрываются. Если масса Ai в девять раз больше массы Cy, вычислите отношение их скоростей при T = 500K. d) Вы берете два моля вещества в части a) и один моль вещества в части b) и помещаете их вместе в изолированный контейнер. Сравните величины изменений тепловой энергии двух веществ по мере их достижения тепловым равновесием. Предположим, что в анализируемом интервале нет изменений в энергии связи. a) Поскольку каждый атом в этом твердом теле может двигаться только в одномерном измерении, на каждый атом приходится 2 моды, одна PE и одна KE. Теплоемкость: \ [C_v = nc_ {v, mol} = 4 \ times \ text {(# режимов на частицу)} \ times \ frac {R} {2} = 33,26 Дж / К \ nonumber \] б) После разрыва слабых связей молекулы AiCy больше не взаимодействуют, поэтому мы получаем двухатомный газ. Если все режимы активны, на молекулу приходится 7 режимов. Поскольку всего имеется 4N A атомов, будет 2N A молекул AiCy. Теплоемкость: \ [C_v = nc_ {v, mol} = 2 \ times 7 \ times \ frac {R} {2} = 58.2} = \ frac {m_ {Ai}} {m_ {Cy}} = 9 \ nonumber \] \ [\ frac {v_ {Cy}} {v_ {Ai}} = 3 \ nonumber \] Таким образом, атомы Cy в среднем движутся в три раза быстрее, чем атомы Ai. d) Чтобы ответить на этот вопрос, нужна только идея энергосбережения. Они находятся в изолированном контейнере: \ [\ Delta E_ {th, a} + \ Delta E_ {th, b} = 0 \ nonumber \] Таким образом, оба будут иметь одинаковую величину изменения тепловой энергии. На рисунке ниже показана молярная теплоемкость постоянного объема, пересчитанная с газовой постоянной, для нескольких газов от комнатной температуры до нескольких тысяч кельвинов. Поскольку \ (c_ {v, mol} / R = \ text {(# режимов на частицу)} / 2 \), график показывает нам, как количество режимов на частицу изменяется в зависимости от температуры. Одноатомные газы имеют самую низкую молярную постоянную объемную теплоемкость \ (\ frac {3} {2} R \), и значения не зависят от температуры.Двухатомные газы, кажется, имеют более высокие значения, начиная примерно с \ (\ frac {5} {2} R \), в то время как многоатомные газы имеют значительно большие значения, но также гораздо более выраженную температурную зависимость. Эти данные говорят нам, что не все режимы активны при любой температуре. Как мы ранее обсуждали при более низкой температуре, в некоторых режимах замораживаются , когда не хватает энергии для преодоления квантовой энергетической щели для возбуждения определенной моды. Например, мы видим, что при комнатной температуре двухатомные молекулы имеют 5 мод вместо возможных 7, что означает, что две колебательные моды неактивны.Эти данные показывают среднее значение для одного моля частиц, поэтому количество режимов изменяется плавно (а не по целочисленному счету), когда моды активируются в увеличивающемся количестве частиц по мере повышения температуры. Рисунок 3.5.4: Зависимость теплоемкости от температуры для различных газов. В таблице ниже показаны характеристики теплоемкости, наблюдаемые в различных газах. Каждый тип газа, например, одноатомный, имеет аналогичные значения удельной теплоты, и значения упорядочиваются от меньшего к большему по мере перехода от одноатомного к двухатомному и трехатомному, как подразумевается уравнением \ ref {Cv}.В следующей главе мы проанализируем, почему удельная теплоемкость газов, измеренная при постоянном давлении, больше, чем при постоянном объеме, а также аналогичную разницу между \ (C_ {mp} \) и \ (C_ {mv} \) для всех газы. Формула тепловой энергии
Q = теплопередача
m = масса
c p = удельная теплоемкость
T f = конечная температура
T i = начальная температура
Q = 0,2 кг * 368 Дж / кгºC * 20 ºC
Q = 1472 Дж.
(T f -T i ) = Q / m * c p
(T f -T i ) = 2500 Дж / (0,2 кг * 4180 Дж / кгºC.)
(T f -T i ) = 2,99 ºC. Урок физики
Удельная теплоемкость
Удельная теплоемкость твердого алюминия (0,904 Дж / г / ° C) отличается от удельной теплоемкости твердого железа (0,449 Дж / г / ° C). Это означает, что для повышения температуры данной массы алюминия на 1 ° C потребуется больше тепла, чем для повышения температуры той же массы железа на 1 ° C.Фактически, для повышения температуры образца алюминия на заданное количество потребуется примерно вдвое больше тепла по сравнению с тем же изменением температуры того же количества железа. Это связано с тем, что удельная теплоемкость алюминия почти вдвое больше, чем у железа.
Какое количество тепла требуется для повышения температуры 450 граммов воды с 15 ° C до 85 ° C? Удельная теплоемкость воды 4.18 Дж / г / ° C.
C = 4,18 Дж / г / ° C
Т начальная = 15 ° С
T окончательная = 85 ° C
Q = 131670 Дж
Q = 1.3×10 5 J = 130 кДж (округлено до двух значащих цифр)
Образец 12,9 грамма неизвестного металла при температуре 26,5 ° C помещают в чашку из пенополистирола, содержащую 50,0 граммов воды при температуре 88,6 ° C. Вода охлаждается, и металл нагревается, пока не будет достигнуто тепловое равновесие при 87,1 ° C. Предполагая, что все тепло, теряемое водой, передается металлу, а чашка идеально изолирована, определите удельную теплоемкость неизвестного металла.Удельная теплоемкость воды составляет 4,18 Дж / г / ° C.
По сравнению с предыдущей проблемой это гораздо более сложная проблема. По сути, эта проблема похожа на две проблемы в одной. В основе стратегии решения проблем лежит признание того, что количество тепла, потерянного водой (Q вода ), равно количеству тепла, полученного металлом (Q металл ). Поскольку значения m, C и ΔT воды известны, можно вычислить Q water .Это значение воды Q равно значению металла Q . Как только значение металла Q известно, его можно использовать со значениями m и ΔT металла для расчета металла Q . Использование этой стратегии приводит к следующему решению:
C = 4,18 Дж / г / ° C
Т начальная = 88,6 ° С
Т финал = 87.1 ° С
ΔT = -1,5 ° C (T конечный — T начальный )
Q вода = -313,5 Дж (без заземления)
(Знак — означает, что вода теряет тепло)
m = 12,9 г
Т начальная = 26,5 ° С
T окончательная = 87,1 ° C
ΔT = (T конечный — T начальный )
C металл = 0,40103 Дж / г / ° C
C металл = 0,40 Дж / г / ° C (округлено до двух значащих цифр)
Тепло и изменения состояния
В случае плавления, кипения и сублимации к образцу вещества должна быть добавлена энергия, чтобы вызвать изменение состояния.Такие изменения состояния называют эндотермическими. Замораживание, конденсация и осаждение экзотермичны; энергия высвобождается образцом материи, когда происходят эти изменения состояния. Таким образом, можно заметить, что образец льда (твердая вода) тает, когда его помещают на горелку или рядом с ней. Тепло передается от горелки к образцу льда; энергия приобретается льдом, вызывая изменение состояния. Но сколько энергии потребуется, чтобы вызвать такое изменение состояния? Есть ли математическая формула, которая могла бы помочь в определении ответа на этот вопрос? Безусловно, есть.
Значения удельной теплоты плавления и удельной теплоты испарения указаны из расчета на количество .Например, удельная теплота плавления воды составляет 333 Дж / грамм. Чтобы растопить 1,0 грамм льда, требуется 333 Дж энергии. Чтобы растопить 10 граммов льда, требуется в 10 раз больше энергии — 3330 Дж. Такое рассуждение приводит к следующим формулам, связывающим количество тепла с массой вещества и теплотой плавления и испарения.
Для испарения и конденсации: Q = m • ΔH испарение
Элиза кладет в свой напиток 48,2 грамма льда. Какое количество энергии будет поглощено льдом (и высвобождено напитком) в процессе таяния? Теплота плавления воды 333 Дж / г.
Q = 16050,6 Дж
Q = 1,61 x 10 4 Дж = 16,1 кДж (округлено до трех значащих цифр)
Какое минимальное количество жидкой воды на 26.5 градусов, которые потребуются, чтобы полностью растопить 50,0 граммов льда? Удельная теплоемкость жидкой воды составляет 4,18 Дж / г / ° C, а удельная теплота плавления льда — 333 Дж / г.
ΔH плавление = 333 Дж / г
Т начальная = 26,5 ° С
T окончательная = 0,0 ° C
ΔT = -26,5 ° C (T конечный — T начальный )
Q лед = 16650 Дж
16650 Дж = -м жидкая вода • C жидкая вода • ΔT жидкая вода
16650 Дж = -м жидкая вода • (4.18 Дж / г / ° C) • (-26,5 ° C)
16650 Дж = -м жидкая вода • (-110,77 Дж / ° C)
м жидкая вода = — (16650 Дж) / (- 110,77 Дж / ° C)
м жидкая вода = 150,311 г
м жидкая вода = 1,50×10 2 г (округлено до трех значащих цифр) Еще раз о кривых нагрева и охлаждения
Жидкая вода: C = 4,18 Дж / г / ° C
Газообразная вода: C = 2.01 Дж / г / ° C
Q 1 = 2,00 x10 3 Дж = 2,00 кДж
Q 2 = 1,665 x10 4 Дж = 16.65 кДж
Q 2 = 16,7 кДж (округлено до 3 значащих цифр)
Q 3 = 2.09 x10 4 Дж = 20,9 кДж
Q 4 = 111,5 кДж
Q 4 = 112 кДж (округлено до 3 значащих цифр)
Q 5 = 2,01 x10 3 J = 2,01 кДж
В приведенном выше примере есть несколько особенностей решения, над которыми стоит задуматься: Проверьте свое понимание
б. По сравнению с другими веществами вода при нагревании быстро нагревается до высоких температур.
c. По сравнению с другими веществами, образец воды требует значительного количества тепла, чтобы немного изменить ее температуру. Процесс Кубик льда помещают в стакан с лимонадом комнатной температуры, чтобы охладить напиток. Холодный стакан лимонада стоит на столе для пикника под жарким полуденным солнцем и нагревается до 32 ° F. Конфорки на электроплите выключаются и постепенно остывают до комнатной температуры. Учитель вынимает из термоса большой кусок сухого льда и опускает его в воду. Сухой лед возгоняется, образуя газообразный диоксид углерода. Водяной пар в увлажненном воздухе ударяется о окно и превращается в каплю росы (каплю жидкой воды). Кинетическая температура, тепловая энергия
у нас есть экспериментально проверенное выражение для молекулярной кинетической энергии. В барометрической формуле: Калькулятор тепловой энергии
Определение кинетической молекулярной теории
Определение тепловой энергии
Уравнение тепловой энергии
U = n * Na * — средняя кинетическая энергия молекул, — средняя скорость молекул, U — полная тепловая энергия газа, f — число степеней свободы, T — температура, M — молярная масса газа, n — количество молей, k — постоянная Больцмана k = 1.23 1 / моль . 3 , что верно для одноатомного газа. Если вы хотите его изменить, перейдите в расширенный режим. Тепловая энергия: определение, уравнение, типы (со схемой и примерами)
Что такое энергия?
Тепловая энергия: наименее полезная форма энергии
Тепловая энергия и температура
Тепло и повседневный мир
Тепловая энергия и сохранение энергии: пример
Уравнение тепловой энергии: теплоемкость
Законы термодинамики
Тепловая энергия и удельная теплоемкость
$$ T_ {final} = {1 \ over 2} (T_1 + T_2) $$
$$ T_ {final} = \ bigg (\ frac {m_1} {m_1 + m_2} \ bigg) T_1 + \ bigg (\ frac {m_2} {m_1 + m_2} \ bigg) T_2 $$ Энергетическая модель общей температуры
Применение уравнения в конкретных примерах
Примечание к агрегатам
3.4: Частичная модель тепловой энергии
Обзор
Частичная модель тепловой энергии
Равное распределение энергии
Режимы счета
Симметричное растяжение Асимметричное растяжение Ножницы (гибка) Тип вещества Режимы перевода Режимы вращения Режимы вибрации Всего режимов на частицу Одноатомный газ 3 0 0 3 3 Теплоемкость при постоянном объеме
Шаблоны данных
газ \ (C_ {mp} \) \ (C_ {mv} \) \ (\ frac {C_ {mv}} {R} \) \ (C_ {mp} — C_ {mv} \) \ (\ frac {(C_ {mp} — C_ {mv})} {R} \) Одноатомный He 20.79 12,52 1,51 8,27 0,99 Ne 20,79 12,68 1,52 8,11 0,98 Ар 20,79 12,45 1,50 8,34 1.00 Ли 20,79 12,45 1,50 8,34 1,00 Xi 20,79 12,52 1,51 8,27 0,99 Двухатомный № 2 29.12 20.80 2,50 8,32 1,00 H 2 28,82 20,44 2,46 8,38 1,01 O 2 29,37 20,98 2,52 8.39 1,01 CO 29,04 20,74 2,49 8,30 1,00 Трехатомный CO 2 36.62 28,17 3,39 8,45 1,02 N 2 O 36,90 28,39 3,41 8,51 1,02 H 2 S 36,12 27,36 3,29 8.

